题目内容
15.图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
| A. | 该试剂的物质的量浓度为9.2 mol•L-1 | |
| B. | 该硫酸50 mL与足量的铜反应可得到标准状况下0.46 mol气体 | |
| C. | 配制200 mL 4.6mol•L-1的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
分析 A.根据c=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度;
B.Cu与浓硫酸反应,与稀硫酸不反应,结合方程式计算判断;
C.根据稀释定律计算;
D.浓硫酸的密度大于水的密度,等体积混合后溶液质量小于浓硫酸的2倍,而混合后溶质硫酸的质量不变,据此判断.
解答 解:由c=$\frac{1000ρω}{M}$可知,该浓硫酸的物质的量浓度为:$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,故A错误;
B.随反应的进行,浓硫酸变为稀硫酸,Cu与稀硫酸不反应,根据Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,可知生成二氧化硫小于0.05L×18.4mol/L×$\frac{1}{2}$=0.46mol,故B错误;
C.根据配制溶液前后硫酸的物质的量不变,需取该硫酸的体积为:$\frac{0.2L×4.6mol/L}{18.4mol/L}$=0.05L=50mL,故C正确;
D.浓硫酸的密度大于水的密度,等体积混合后溶液质量小于浓硫酸的2倍,而混合后溶质硫酸的质量不变,所以该硫酸与等体积的水混合所得溶液的质量分数大于49%,故D错误;
故选C.
点评 本题考查溶液浓度有关计算,题目难度中等,涉及物质的量浓度、质量分数计算,理解掌握物质的量浓度与质量分数之间关系为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
5.气态原子生成+1价气态阳离子所需要的能量称为第一电离能.元素的第一电离能是衡量元素金属性强弱的一种尺度.下列有关说法正确的是( )
| A. | 元素的第一电离能越大,其金属性越强 | |
| B. | 元素的第一电离能越小,其金属性越强 | |
| C. | 金属单质跟酸反应的难易,只跟该金属元素的第一电离能有关 | |
| D. | 同周期元素,第一电离能随原子序数增大逐渐增大 |
3.有一瓶Na2SO3溶液,可能部分被氧化.某同学用此溶液进行如下实验:取少量溶液,滴入硝酸钡溶液产生白色沉淀,再加入足量稀硝酸,充分振荡后仍有白色沉淀.对此实验下列结论正确的是( )
| A. | Na2SO3已部分氧化 | |
| B. | 加入硝酸钡溶液生成的沉淀一定含BaSO4 | |
| C. | 加入硝酸后的沉淀一定含BaSO3 | |
| D. | 此实验不能确定Na2SO3是否部分氧化 |
20.今有①CH3COOH;②HCl;③H2SO4三种溶液,(1)~(3)题请选择填空:
A.①>②>③B.①<②<③C.①=②=③E.①>②=③
D.①=③>②F.①<②=③G.①=②<③H.①=②>③
(1)当它们pH相同时,其物质的量浓度关系是A.
(2)体积和物质的量浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为B.
(3)当它们pH相同、体积相同时,分别加入足量锌,则开始时反应速率C,相同状况下产生气体体积关系为E.
(4)某学生用0.2000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准NaOH溶液注入滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
①正确操作的顺序是(用序号字母填写)B→D→C→E→A→F
②实验中,眼睛应注视锥形瓶中溶液颜色的变化,直至滴定终点.
③几次滴定消耗NaOH溶液的体积如下:
则该盐酸溶液的准确浓度为0.2000mol/L.(保留小数点后4位)
(5)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是:ADE
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗滴定管.
A.①>②>③B.①<②<③C.①=②=③E.①>②=③
D.①=③>②F.①<②=③G.①=②<③H.①=②>③
(1)当它们pH相同时,其物质的量浓度关系是A.
(2)体积和物质的量浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为B.
(3)当它们pH相同、体积相同时,分别加入足量锌,则开始时反应速率C,相同状况下产生气体体积关系为E.
(4)某学生用0.2000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准NaOH溶液注入滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
①正确操作的顺序是(用序号字母填写)B→D→C→E→A→F
②实验中,眼睛应注视锥形瓶中溶液颜色的变化,直至滴定终点.
③几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
(5)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是:ADE
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗滴定管.
4.碳是地球上组成生命的最基本元素之一,可以sp3、sp2和sp杂化轨道成共价键,具有很强的结合能力,与其它元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界.碳及其化合物在研究和生产中有许多重要用途.请回答下列问题:
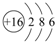
(1)基态碳原子核外有6种空间运动状态的电子,其价电子排布图为 .
.
(2)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为平面三角形,其碳原子杂化轨道类型为sp2杂化.
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:
试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解
(4)碳的一种同素异形体--C60,又名足球烯,是一种高度对称的球碳分子.立方烷(分子式:C8H8结构是立方体: 是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
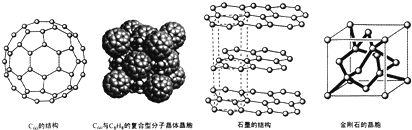
(5)碳的另一种同素异形体--石墨,其晶体结构如图所示,虚线勾勒出的是其晶胞.则石墨晶胞含碳原子个数为4个.已知石墨的密度为ρg.cm-3,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为$\frac{\sqrt{3}}{16}$ρNAr2cm.
(1)基态碳原子核外有6种空间运动状态的电子,其价电子排布图为
 .
.(2)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为平面三角形,其碳原子杂化轨道类型为sp2杂化.
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:
| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
(4)碳的一种同素异形体--C60,又名足球烯,是一种高度对称的球碳分子.立方烷(分子式:C8H8结构是立方体:
 是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
(5)碳的另一种同素异形体--石墨,其晶体结构如图所示,虚线勾勒出的是其晶胞.则石墨晶胞含碳原子个数为4个.已知石墨的密度为ρg.cm-3,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为$\frac{\sqrt{3}}{16}$ρNAr2cm.
5.可以制取较为纯净的溴乙烷的方法是( )
| A. | 乙烷通入溴水中 | B. | 乙烯与溴化氢反应 | ||
| C. | 乙烯通入溴水中 | D. | 乙烷与溴蒸气在光照下反应 |
 铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:
铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:
 .
. .
. .
.