题目内容
1.乙苯催化脱氢生产苯乙烯的反应:
(1)一定温度下,将a mol乙苯加入体积为V L的密闭容器中,发生上述反应,反应时间与容器内气体总压强的数据如表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
②列式计算此温度下该反应的平衡常数K$\frac{4a}{15V}$.
(2)根据化学反应原理,分析减小压强对该反应的影响该反应分子数增加,减小压强使平衡右移,乙苯转化率增大,苯乙烯产率增加,减小压强使乙苯浓度减小,反应速率减小.
分析 (1)①根据压强与气体物质的量成正比确定反应后气体的总物质的量;利用差量法计算出反应消耗乙苯的物质的量,然后计算出乙苯的转化率;
②利用三段式计算出平衡时各组分的物质的量,然后利用平衡常数表达式计算出该温度下该反应的平衡常数;
(2)该反应为气体体积增大的反应,减小压强后平衡向着气体体积增大的反应方向移动;再结合压强对反应速率的影响分析.
解答 解:(1)①容器容积固定,则容器内压强与气体的总物质的量成正比,根据表中数据可知,达到平衡时压强为反应前的1.4倍,则平衡时气体的总物质的量为:amol×1.4=1.4amol;
平衡时气体的物质的量增大:1.4amol-amol=0.4amol,设有x mol 乙苯发生转化, △n
△n
1 1 1 1
xmol 0.4amol
则:x=$\frac{0.4amol×1}{1}$=0.4amol,
所以乙苯的转化率为:$\frac{0.4amol}{amol}$×100%=40%,
故答案为:1.4a;40%;
②发生反应为
反应前(mol) a 0 0
转化(mol) 0.4a 0.4a 0.4a
平衡时(mol) 0.6a 0.4a 0.4a
则该反应的平衡常数为:K=$\frac{\frac{0.4a}{V}×\frac{0.4a}{V}}{\frac{0.6a}{V}}$=$\frac{4a}{15V}$,
故答案为:$\frac{4a}{15V}$;
(2)根据反应方程式可知,该反应中气体的分子数增加,则减小压强后平衡右移,乙苯转化率增大,苯乙烯产率增加;减小压强后使乙苯浓度减小,则反应速率减小,
故答案为:该反应分子数增加,减小压强使平衡右移,乙苯转化率增大,苯乙烯产率增加,减小压强使乙苯浓度减小,反应速率减小.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握三段式在化学平衡的计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

 名校课堂系列答案
名校课堂系列答案| A. | C的体积分数增大 | B. | 平衡向右移动 | C. | B的转化率提高 | D. | a+b<c+d |
| A. | 乙烷通入溴水中 | B. | 乙烯与溴化氢反应 | ||
| C. | 乙烯通入溴水中 | D. | 乙烷与溴蒸气在光照下反应 |
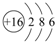
| A. | 3和9 | B. | 6和8 | C. | 13和17 | D. | 15和17 |
| A. | 0.1molNa2O2中含有的离子数为0.4NA | |
| B. | 利用氧化还原反应原理制取1mol氧气,转移的电子数一定为4NA | |
| C. | 7.1g氯气与足量NaOH溶液反应电子转移数为0.2NA | |
| D. | 0.1mol氯气与金属铁完全反应时,转移电子数为0.2NA |

 .
. .
.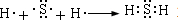 .
. 燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.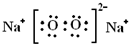 .
.