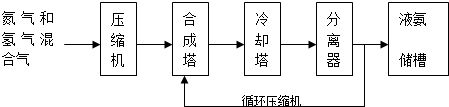
题目内容
17.下列溶液中溶质的物质的量浓度为1mol/L 的是( )| A. | 称40.0 g 氢氧化钠固体解于1L水中配成1L的氢氧化钠溶液 | |
| B. | 常温常压下将22.4L氯化氢气体溶于水配成1L的盐酸溶液 | |
| C. | 将1L 10mol/L的浓盐酸与水混合配成10L溶液 | |
| D. | 从1000mL 2mol/L NaCl溶液中取出500mL的溶液 |
分析 A.体积指溶液体积不是溶剂体积;
B.根据温度、压强对气体摩尔体积的影响分析判断;
C.根据溶质浓度c=$\frac{n}{V}$计算;
D.浓度与所取体积多少无关.
解答 解:A.体积指溶液体积不是溶剂体积,所以40gNaOH溶解于1L水中配成的NaOH溶液浓度不是1mol/L,故A错误;
B.气体摩尔体积受温度和压强的影响,温度越高,气体摩尔体积越大,标况下,22.4LHCl的物质的量是1mol,常温常压下,22.4LHCl的物质的量小于1mol,所以常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液的物质的量浓度不是1mol/L,故B错误;
C.将1L 10mol/L的浓盐酸与水混合配成10L溶液,溶质浓度=$\frac{1L×10mol/L}{10L}$=1mol/L,所以混合后溶液的物质的量浓度是1mol/L,故C正确;
D.因为浓度与所取体积多少无关,所以从1000mL 2mol/L NaCl溶液中取出500mL的溶液,浓度仍然为2mol/L,故D错误.
故选C.
点评 本题考查学生对物质的量浓度的理解,比较基础,注意B选项中气体摩尔体积的使用条件与对象,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列物质反应后一定有+3价铁生成的是( )
①过量的Fe与Cl2加热时发生反应 ②Fe与过量稀H2SO4反应后,再向其中加KNO3 ③Fe与过量的S加热时发生反应 ④Fe(NO3)2溶液中加少量盐酸 ⑤Fe和Fe2O3的混合物溶于盐酸中.
①过量的Fe与Cl2加热时发生反应 ②Fe与过量稀H2SO4反应后,再向其中加KNO3 ③Fe与过量的S加热时发生反应 ④Fe(NO3)2溶液中加少量盐酸 ⑤Fe和Fe2O3的混合物溶于盐酸中.
| A. | ①③⑤ | B. | ①②④ | C. | ②④⑤ | D. | ①④⑤ |
2.将6.0mol•L-1 H2SO4溶液由10mL稀释至200mL,再从中取出20mL,这20mL溶液的物质的量浓度是( )
| A. | 0.05mol•L-1 | B. | 0.30 mol•L-1 | C. | 0.15 mol•L-1 | D. | 0.5 mol•L-1 |
20.在标准状况下①6.72L CH4;②3.01×1023个HCl分子;③13.6g H2S;④0.2mol NH3.下列对这四种气体的关系从大到小表达不正确的是( )
| A. | 体积②>③>①>④ | B. | 密度②>④>③>① | ||
| C. | 氢原子个数②>①>③>④ | D. | 质量②>③>①>④ |
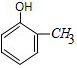 2-甲基苯酚、
2-甲基苯酚、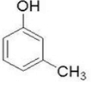 3-甲基苯酚、
3-甲基苯酚、 4-甲基苯酚.
4-甲基苯酚.