题目内容
2.将6.0mol•L-1 H2SO4溶液由10mL稀释至200mL,再从中取出20mL,这20mL溶液的物质的量浓度是( )| A. | 0.05mol•L-1 | B. | 0.30 mol•L-1 | C. | 0.15 mol•L-1 | D. | 0.5 mol•L-1 |
分析 稀释前后溶质的物质的量不变,结合溶液具有均一性来解答.
解答 解:稀释至200mL后浓度为$\frac{6mol/L×0.01L}{0.2L}$=0.30 mol•L-1,由溶液具有均一性可知,从中取出20mL,这20mL溶液的物质的量浓度是0.30 mol•L-1,
故选B.
点评 本题考查物质的量浓度的计算,为高频考点,把握稀释定律及溶液均一性为解答关键,侧重分析与计算能力的考查,注意溶液的性质,题目难度不大.

练习册系列答案
相关题目
12.下列关于胶体和溶液的说法中正确的是( )
| A. | 胶体不均一、不稳定,静置后易产生沉淀,溶液均一、稳定、静置不产生沉淀 | |
| B. | 溶液和胶体都是纯净物,浊液是混合物 | |
| C. | 光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应 | |
| D. | 只有胶状物如胶水、果冻类的物质才能称为胶体 |
13.下列说法正确的是( )
| A. | 物质不是电解质就是非电解质 | |
| B. | 酸性氧化物不一定都是非金属氧化物,而非金属氧化物一定是酸性氧化物 | |
| C. | 能导电的物质不一定是电解质,电解质不一定能导电 | |
| D. | 液氨溶于水能导电,所以是电解质 |
10.下列物质发生变化时,所克服的粒子间相互作用属于分子间作用力的是( )
| A. | 酒精受热变为气体 | B. | 氯化铵受热变为气体 | ||
| C. | 二氧化硅受热熔化 | D. | 食盐溶解在水中 |
17.下列溶液中溶质的物质的量浓度为1mol/L 的是( )
| A. | 称40.0 g 氢氧化钠固体解于1L水中配成1L的氢氧化钠溶液 | |
| B. | 常温常压下将22.4L氯化氢气体溶于水配成1L的盐酸溶液 | |
| C. | 将1L 10mol/L的浓盐酸与水混合配成10L溶液 | |
| D. | 从1000mL 2mol/L NaCl溶液中取出500mL的溶液 |
7.大力开发低碳技术,推广高效节能技术,积极发展新能源和可再生能源.下列有关做法与此不相符的是( )
| A. | 回收废弃的饮料包装纸,制作成公园内的休闲长椅 | |
| B. | 大力开发丰富的煤炭资源,减少对石油的依赖 | |
| C. | 在西部和沿海地区兴建风力发电站,解决能源问题 | |
| D. | 鼓励购买小排量汽车,推广电动、混合动力汽车 |
4. (1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).
(1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).
(2)配制完毕后,用标准Na2CO3溶液滴定未知浓度的盐酸时,Na2CO3溶液应装在碱式滴定管中.若采用上述标准Na2CO3溶液滴定,滴定时实验数据列表如下:
则c(HCl)=0.85mol•L-1.
(3)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度偏高,若原来配制所称取的Na2CO3固体中混有Na2CO3•10H2O,则实验误差为偏高(以上两空填“偏高”、“偏低”或“无影响”)
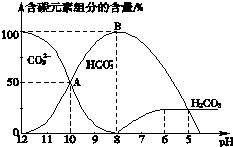
(4)常温下向20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液pH逐渐降低,此时溶液中含碳元素的微粒的物质的量浓度的百分含量(纵轴)发生的变化(CO2因逸出未画出)如图所示,根据图示回答下列问题:
①请写出AB段反应的离子方程式CO32-+H+=HCO3-
②当反应到A点时,溶液中所有阳离子和阴离子的浓度大小关系为(氯离子浓度除外)c(Na+)+c(H+)>2c(CO32-)+c(HCO3-)+c(OH-).
 (1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).
(1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).(2)配制完毕后,用标准Na2CO3溶液滴定未知浓度的盐酸时,Na2CO3溶液应装在碱式滴定管中.若采用上述标准Na2CO3溶液滴定,滴定时实验数据列表如下:
| 次数编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
(3)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度偏高,若原来配制所称取的Na2CO3固体中混有Na2CO3•10H2O,则实验误差为偏高(以上两空填“偏高”、“偏低”或“无影响”)
(4)常温下向20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液pH逐渐降低,此时溶液中含碳元素的微粒的物质的量浓度的百分含量(纵轴)发生的变化(CO2因逸出未画出)如图所示,根据图示回答下列问题:
①请写出AB段反应的离子方程式CO32-+H+=HCO3-
②当反应到A点时,溶液中所有阳离子和阴离子的浓度大小关系为(氯离子浓度除外)c(Na+)+c(H+)>2c(CO32-)+c(HCO3-)+c(OH-).
5.某元素的M层有4个P电子,下列叙述错误的是( )
| A. | N层不含电子 | B. | 该元素是硫元素 | ||
| C. | L层一定有8个电子 | D. | 原子最外层电子数为4 |
 CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)?CO(g)+3H2(g).
CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)?CO(g)+3H2(g).