题目内容
20.在标准状况下①6.72L CH4;②3.01×1023个HCl分子;③13.6g H2S;④0.2mol NH3.下列对这四种气体的关系从大到小表达不正确的是( )| A. | 体积②>③>①>④ | B. | 密度②>④>③>① | ||
| C. | 氢原子个数②>①>③>④ | D. | 质量②>③>①>④ |
分析 A.同温同压条件下,气体的体积之比等于物质的量之比:
B.依据ρ=$\frac{M}{Vm}$判断;
C.依据各物质的物质的量与分子结构与组成解答;
D.根据m=nM计算.
解答 解:①6.72L CH4$\frac{6.72L}{222.4Lmol}$=0.3mol;②3.01×1023个HCl分子物质的量为$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}mol{\;}^{-1}}$=0.5mol;③13.6g H2S物质的量为$\frac{13.6g}{34g/mol}$=0.4mol;④0.2mol NH3.
A.同温同压条件下,气体的体积之比等于物质的量之比,所以体积②>③>①>④,故A正确;
B.依据ρ=$\frac{M}{Vm}$可知,同温同压条件下,密度与M成正比,甲烷:1617g/mol,氯化氢:36.517g/mol,硫化氢3417g/mol,氨气:17g/mol,所以密度②>③>④>①,故B错误;
C.①②③④中H原子物质的量分别是1.2mol、0.5mol、0.8mol、0.6mol,氢原子个数大小顺序是①>③>④>②,故C错误;
D..①中质量=0.3mol×16g/mol=4.8g,②中质量=0.5mol×36.5g/mol=18.25g,③中质量为13.6g,④中质量=0.2mol×17g/mol=3.4g,所以质量②>③>①>④,故D正确;
故选:BC.
点评 本题考查了物质的量的有关计算,侧重考查学生分析计算能力,掌握基本公式及其公式间的转化是解本题关键,注意信息中的标况、物质的构成等,题目难度不大.

练习册系列答案
相关题目
17.下列溶液中溶质的物质的量浓度为1mol/L 的是( )
| A. | 称40.0 g 氢氧化钠固体解于1L水中配成1L的氢氧化钠溶液 | |
| B. | 常温常压下将22.4L氯化氢气体溶于水配成1L的盐酸溶液 | |
| C. | 将1L 10mol/L的浓盐酸与水混合配成10L溶液 | |
| D. | 从1000mL 2mol/L NaCl溶液中取出500mL的溶液 |
11.从下列实验操作、现象得出的相应结论不正确的是( )
| 选项 | 实验操作、现象 | 结论 |
| A | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体;另取原溶液少许,向其中滴加CaCl2溶液,有白色沉淀生成 | 确定该溶液存在CO32- |
| B | 氯水中存在多种分子和离子,向新制氯水中加入有色布条,片刻后有色布条褪色 | 说明氯水中有HClO存在 |
| C | 将淀粉与KCl混合液装于半透膜内,浸泡在盛蒸馏水的烧杯中,5min后取烧杯中液体,加碘水变蓝色 | 证明半透膜有破损 |
| D | 将气体通入盛饱和碳酸钠溶液的洗气瓶 | 可用于除去中CO2的HCl |
| A. | A | B. | B | C. | C | D. | D |
15.下列过程中所发生的化学变化属于取代反应的是( )
| A. | 光照射甲烷和氯气的混合气体 | |
| B. | 乙烯通入溴水中 | |
| C. | 在镍作催化剂条件下,苯与氢气反应 | |
| D. | 苯与液溴混合后撒入铁粉 |
5.某元素的M层有4个P电子,下列叙述错误的是( )
| A. | N层不含电子 | B. | 该元素是硫元素 | ||
| C. | L层一定有8个电子 | D. | 原子最外层电子数为4 |
12.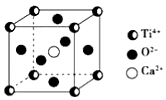 CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )
CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )
 CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )
CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )| A. | CaTiO3的摩尔质量为136 | |
| B. | CaTiO3晶体中每个Ti4+与12个Ca2+紧相邻 | |
| C. | CaTiO3晶体中每个Ti4+与12个O2-紧相邻 | |
| D. | CaTiO3晶体中每个Ti4+与12个Ti4+紧相邻 |
9.在澄清透明溶液中,下列各组离子能大量共存的是( )
| A. | HCO3-、ClO-、Na+、H+ | B. | Cl-、NH4+、NO3-、H+ | ||
| C. | K+、Cu2+、Cl-、SO42- | D. | OH-、Mg2+、Na+、CO32- |