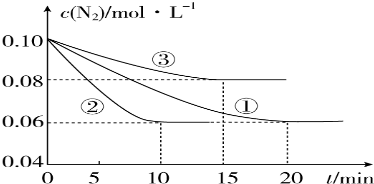
题目内容
7.已知元素X、Y的核电荷数分别为a和b,它们的离子Xm+和Yn-核外电子排布相同,则a、b、m、n之间的关系是a=b+n+m.分析 离子Xm+和Yn-核外电子排布相同,可知离子的电子数相同,结合原子失去电子转化为阳离子、得到电子转化为阴离子来解答.
解答 解:元素X、Y的核电荷数分别为a和b,它们的离子Xm+和Yn-核外电子排布相同,可知离子的电子数相同,则a-m=b+n,即a=b+n+m,
故答案为:a=b+n+m.
点评 本题考查原子结构与周期律,为高频考点,把握离子的电子数相同为解答关键,侧重分析与应用能力的考查,注意原子与离子中电子数关系,题目难度不大.

练习册系列答案
相关题目
15.常温下,下列有关溶液pH的相关说法正确的是( )
| A. | 将pH=11的氢氧化钠溶液加水稀释100倍,溶液中c(H+)=10-13 mol•L-1 | |
| B. | 将pH=9的氢氧化钠溶液和pH=13的氢氧化钡溶液等体积混合,所得混合溶液的pH=11 | |
| C. | 将pH=13的氢氧化钡溶液和pH=1的盐酸等体积混合,由于氢氧化钡过量,所得溶液的pH>7 | |
| D. | 将pH=1的硫酸和pH=5的盐酸等体积混合,所得混合溶液的pH=1.3 |
2.某溶液中发生反应:A?2B+C,A的反应速率v(A)与时间t的图象如图所示.若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( )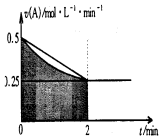

| A. | 0-2min,速率不断减少的主要原因是A的浓度减少 | |
| B. | 反应开始前2min,C的浓度增加量等于A的浓度减少量 | |
| C. | 至2min时,A的物质的量减小值可能是0.5mol | |
| D. | 至2min时,c(B)介于1mol•L-1 至1.5mol•L-1 之间 |
12.下列关于胶体和溶液的说法中正确的是( )
| A. | 胶体不均一、不稳定,静置后易产生沉淀,溶液均一、稳定、静置不产生沉淀 | |
| B. | 溶液和胶体都是纯净物,浊液是混合物 | |
| C. | 光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应 | |
| D. | 只有胶状物如胶水、果冻类的物质才能称为胶体 |
19.化学与科学、技术、社会、环境密切相关.下列有关说法中不正确的是( )
| A. | 在我国上海举办的世博会采取了许多节能环保措施,充分利用太阳能是其中之一 | |
| B. | 氧化铝陶瓷是一种超硬物质,能抵抗冷热冲击,是一种高压钠灯灯管的良好材料 | |
| C. | 空气污染指数的项目包括:二氧化硫、二氧化氮和可吸入颗粒物等 | |
| D. | 为了防止食物腐败,可以向食品中加入大量的NaNO2 |
16.下列变化过程中,△S<0的是( )
| A. | NH3(g)与HCl(g)反应生成NH4Cl(s) | B. | 氯化钠溶于水中 | ||
| C. | CaCO3(S)分解为CaO(S)和CO2(g) | D. | 干冰(CO2)的升华 |
17.下列溶液中溶质的物质的量浓度为1mol/L 的是( )
| A. | 称40.0 g 氢氧化钠固体解于1L水中配成1L的氢氧化钠溶液 | |
| B. | 常温常压下将22.4L氯化氢气体溶于水配成1L的盐酸溶液 | |
| C. | 将1L 10mol/L的浓盐酸与水混合配成10L溶液 | |
| D. | 从1000mL 2mol/L NaCl溶液中取出500mL的溶液 |