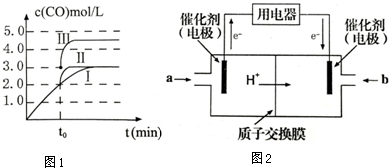
题目内容
19.在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:H2(g)+I2(g)?2HI(g)△H<0.改变下列条件,反应速率和平衡分别将如何改变?(选填“增大”“减小”或“不变”)(1)升高温度,速率增大平衡向逆反应方向移动;
(2)加入催化剂,速率增大平衡向不移动
(3)充入更多的H2,速率增大平衡向正反应方向移动
(4)扩大容器的体积,速率减小 平衡向不移动
(5)保持容器容积不变,通入氖气,速率不变平衡向不移动.
分析 改变影响反应速率条件,增大浓度、增大压强、使用催化剂,反应速率加快,反之反应速率减慢,反应体系中各物质的浓度不变,则反应速率不变,反应中H2(g)+I2(g)?2HI(g)△H<0,气体的化学计量数之和反应前后相等,则增大压强、减小压强平衡不移动,正反应放热,升高温度平衡向逆反应方向移动,增大反应物浓度,平衡向正反应方向移动,结合影响反应速率的条件解答该题.
解答 解:(1)升高温度,反应速率增大,正逆反应速率都增大,平衡向吸热的方向移动,反应:H2(g)+I2(g)?2HI(g)△H<0,正反应放热,升高温度平衡向逆反应方向移动,
故答案为:增大;逆反应方向;
(2)加入催化剂,反应速率增大,催化剂能同等程度加快正逆反应速率,所以平衡不移动,
故答案为:增大;不;
(3)再充入H2,反应物浓度增大,化学反应速率增大,增大反应物浓度,平衡向正反应方向移动,
故答案为:增大;正反应方向;
(4)将容器容积扩大,相当于减小压强,则反应速率减小,因该反应气体的化学计量数之和反应前后相等,则平衡不移动;
故答案为:减小;不;
(5)容器容积不变,通入氖气,反应体系中各物质的浓度不变,则反应速率不变,反应速率不变,平衡不移动,
故答案为:不变;不.
点评 本题考查化学平衡和反应速率的影响,题目难度不大,注意把握影响因素和影响原因,注重基础知识的学习.

练习册系列答案
相关题目
16.下列变化过程中,△S<0的是( )
| A. | NH3(g)与HCl(g)反应生成NH4Cl(s) | B. | 氯化钠溶于水中 | ||
| C. | CaCO3(S)分解为CaO(S)和CO2(g) | D. | 干冰(CO2)的升华 |
17.下列溶液中溶质的物质的量浓度为1mol/L 的是( )
| A. | 称40.0 g 氢氧化钠固体解于1L水中配成1L的氢氧化钠溶液 | |
| B. | 常温常压下将22.4L氯化氢气体溶于水配成1L的盐酸溶液 | |
| C. | 将1L 10mol/L的浓盐酸与水混合配成10L溶液 | |
| D. | 从1000mL 2mol/L NaCl溶液中取出500mL的溶液 |
4. (1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).
(1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).
(2)配制完毕后,用标准Na2CO3溶液滴定未知浓度的盐酸时,Na2CO3溶液应装在碱式滴定管中.若采用上述标准Na2CO3溶液滴定,滴定时实验数据列表如下:
则c(HCl)=0.85mol•L-1.
(3)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度偏高,若原来配制所称取的Na2CO3固体中混有Na2CO3•10H2O,则实验误差为偏高(以上两空填“偏高”、“偏低”或“无影响”)
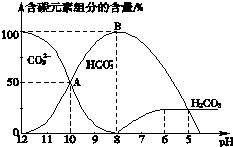
(4)常温下向20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液pH逐渐降低,此时溶液中含碳元素的微粒的物质的量浓度的百分含量(纵轴)发生的变化(CO2因逸出未画出)如图所示,根据图示回答下列问题:
①请写出AB段反应的离子方程式CO32-+H+=HCO3-
②当反应到A点时,溶液中所有阳离子和阴离子的浓度大小关系为(氯离子浓度除外)c(Na+)+c(H+)>2c(CO32-)+c(HCO3-)+c(OH-).
 (1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).
(1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).(2)配制完毕后,用标准Na2CO3溶液滴定未知浓度的盐酸时,Na2CO3溶液应装在碱式滴定管中.若采用上述标准Na2CO3溶液滴定,滴定时实验数据列表如下:
| 次数编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
(3)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度偏高,若原来配制所称取的Na2CO3固体中混有Na2CO3•10H2O,则实验误差为偏高(以上两空填“偏高”、“偏低”或“无影响”)
(4)常温下向20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液pH逐渐降低,此时溶液中含碳元素的微粒的物质的量浓度的百分含量(纵轴)发生的变化(CO2因逸出未画出)如图所示,根据图示回答下列问题:
①请写出AB段反应的离子方程式CO32-+H+=HCO3-
②当反应到A点时,溶液中所有阳离子和阴离子的浓度大小关系为(氯离子浓度除外)c(Na+)+c(H+)>2c(CO32-)+c(HCO3-)+c(OH-).
11.从下列实验操作、现象得出的相应结论不正确的是( )
| 选项 | 实验操作、现象 | 结论 |
| A | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体;另取原溶液少许,向其中滴加CaCl2溶液,有白色沉淀生成 | 确定该溶液存在CO32- |
| B | 氯水中存在多种分子和离子,向新制氯水中加入有色布条,片刻后有色布条褪色 | 说明氯水中有HClO存在 |
| C | 将淀粉与KCl混合液装于半透膜内,浸泡在盛蒸馏水的烧杯中,5min后取烧杯中液体,加碘水变蓝色 | 证明半透膜有破损 |
| D | 将气体通入盛饱和碳酸钠溶液的洗气瓶 | 可用于除去中CO2的HCl |
| A. | A | B. | B | C. | C | D. | D |
9.在澄清透明溶液中,下列各组离子能大量共存的是( )
| A. | HCO3-、ClO-、Na+、H+ | B. | Cl-、NH4+、NO3-、H+ | ||
| C. | K+、Cu2+、Cl-、SO42- | D. | OH-、Mg2+、Na+、CO32- |
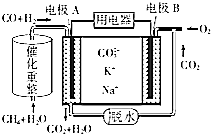 CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)?CO(g)+3H2(g).
CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)?CO(g)+3H2(g).