题目内容
1.材料是人类赖以生存和发展的重要物质基础.①下列属于复合材料的是c(填字母).
a.有机玻璃b.钢化玻璃 c.玻璃钢 d.石英玻璃
②1928年美国杜邦公司首先合成了尼龙,由尼龙制成的尼龙丝耐磨、柔韧、有光泽,可作为丝绸的代替品,尼龙属于a(填字母).
a.有机高分子材料 b.无机非金属材料c.金属材料.
分析 ①复合材料是由两种或两种以上不同性质的材料,通过物理或化学的方法,在宏观上组成具有新性能的材料;
②材料分为金属材料、无机非金属材料、合成材料和复合材料、有机合成高分子材料,利用题干提供的信息结合相关的化学知识即可解题.
解答 解:①a.有机玻璃是化学合成的一种塑料,外观颇似玻璃,属于合成材料;
b.钢化玻璃属于硅酸盐材料,属无机非金属材料;
c.玻璃钢是玻璃纤维与合成材料复而成的一种特殊材料,属于复合材料;
d.石英玻璃的主要成分是二氧化硅,属无机非金属材料;
故答案为:c;
②尼龙含有碳元素,属于有机化合物,属于有机高分子材料,故答案为:a.
点评 本题考查无机非金属材料,为基础性习题,把握物质的性质及物质的组成为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
11.下列反应中,调节反应物用量或浓度不会改变反应产物的是( )
| A. | 钠在氧气中燃烧 | B. | NaOH溶液滴入NH4HCO3溶液 | ||
| C. | 稀硝酸中加入铁粉 | D. | 镁与H2SO4溶液 |
12.可以用离子方程式Fe3++3OH-=Fe(OH)3↓来表示的化学反应是( )
| A. | Fe2(SO4)3+6NH3•H2O=3(NH4)2SO4+2Fe(OH)3↓ | |
| B. | FeCl3+3NaOH=Fe(OH)3↓+3NaCl | |
| C. | Fe2(SO4)3+3Ba(OH)2=2Fe(OH)3↓+3BaSO4↓ | |
| D. | FeCl2+2KOH=Fe(OH)2↓+2KCl |
16.氢能是高效清洁的合体能源,也是一种极具发展潜力的清洁能源.

(1)以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法.其反应过程如图1所示:
①反应Ⅰ的离子方程式是SO2+2H2O+I2=SO42-+2I-+4H+,反应Ⅰ得到的产物用I2进行分离,该产物的溶液在过量I2的存在下会分成两层:含低浓度I2的H2SO4层和含高浓度I2的HI层.经离子浓度检测,H2SO4溶液层中c(H+):c(SO42-)=2.06:1,其比值大于2的原因是硫酸层中含少量的HI,且HI电离出氢离子
②反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ•mo1-1
它由两步反应组成:ⅰ.H2SO4(l)=SO3(g)+H2O(g)△H=+177kJ•mo1-1;
ⅱ.SO3(g)分解写出SO3(g)分解的热化学方程式2SO3(g)?2SO2(g)+O2(g)△H=+196kJ•mol-1.
(2)工业上利用吸热反应C(s)+2H2O(g)═CO2(g)+2H2(g),也可制备氢气.一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,其相关数据如表所示:
①T1℃时,该反应的平衡常数K=12.8.T1>T2(填“>”、“=”或“<”);
②若乙容器中达到平衡所需时间为3min,则当反应进行到1.5min时,H2O(g)的物质的量的浓度B(填选项字母).
A.=1.4mol/L B.<1.4mol/L C.>1.4mol/L
③某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图2所示.可见在t1、t3、t5、t7时反应都达到了平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则从t1到t8哪个时间段H2O (g)的平衡转化率最低t7-t8,t4时刻改变的条件是降低温度.
(3)如图3是一种电化学制备H2的方法,装置中的MEA为允许质子通过的电解质膜.
①写出阳极电极的反应式:CH3OH+H2O-6e-=CO2↑+6H+.
②电解产生的氢气可以用镁铝合金(Mg17Al12)来储存,合金吸氢后得到仅含一种金属的氢化物(其中氢的质量分数为0.077)和一种金属单质,该反应的化学方程式为Mg17Al12+17H2=17MgH2+12Al.

(1)以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法.其反应过程如图1所示:
①反应Ⅰ的离子方程式是SO2+2H2O+I2=SO42-+2I-+4H+,反应Ⅰ得到的产物用I2进行分离,该产物的溶液在过量I2的存在下会分成两层:含低浓度I2的H2SO4层和含高浓度I2的HI层.经离子浓度检测,H2SO4溶液层中c(H+):c(SO42-)=2.06:1,其比值大于2的原因是硫酸层中含少量的HI,且HI电离出氢离子
②反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g)△H=+550kJ•mo1-1
它由两步反应组成:ⅰ.H2SO4(l)=SO3(g)+H2O(g)△H=+177kJ•mo1-1;
ⅱ.SO3(g)分解写出SO3(g)分解的热化学方程式2SO3(g)?2SO2(g)+O2(g)△H=+196kJ•mol-1.
(2)工业上利用吸热反应C(s)+2H2O(g)═CO2(g)+2H2(g),也可制备氢气.一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,其相关数据如表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | |
| C(s) | H2O(g) | H2(g) | |||
| 甲 | 2 | T1 | 2 | 4 | 3.2 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 |
②若乙容器中达到平衡所需时间为3min,则当反应进行到1.5min时,H2O(g)的物质的量的浓度B(填选项字母).
A.=1.4mol/L B.<1.4mol/L C.>1.4mol/L
③某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图2所示.可见在t1、t3、t5、t7时反应都达到了平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则从t1到t8哪个时间段H2O (g)的平衡转化率最低t7-t8,t4时刻改变的条件是降低温度.
(3)如图3是一种电化学制备H2的方法,装置中的MEA为允许质子通过的电解质膜.
①写出阳极电极的反应式:CH3OH+H2O-6e-=CO2↑+6H+.
②电解产生的氢气可以用镁铝合金(Mg17Al12)来储存,合金吸氢后得到仅含一种金属的氢化物(其中氢的质量分数为0.077)和一种金属单质,该反应的化学方程式为Mg17Al12+17H2=17MgH2+12Al.
6.某微粒用${\;}_{Z}^{A}$Rn+表示,下列关于该微粒的叙述中正确的是( )
| A. | 所含质子数=A-n | B. | 质子数=Z+A | C. | 所含电子数=Z+n | D. | 所含中子数=A-Z |
13.在用锌片、铜片和稀硫酸组成的原电池装置中,经过一段时间后,下列说法正确的是( )
| A. | 铜片上有气泡产生,发生还原反应 | B. | 锌是负极,发生还原反应 | ||
| C. | 电流方向是从锌片沿导线流向铜片 | D. | 铜片逐渐溶解,被氧化 |

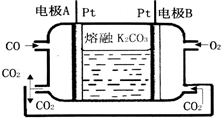 碳及其化合物与人类生产、生活密切相关.
碳及其化合物与人类生产、生活密切相关.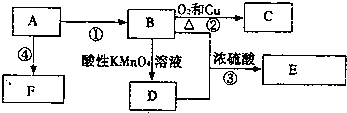

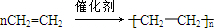 ,反应类型加聚反应.
,反应类型加聚反应.