题目内容
18.已知:A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料.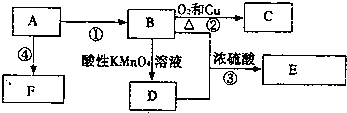
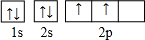
(1)A的电子式为

(2)D分子中的官能团名称是羧基,请设计一种实验来验证D物质存在该官能团的方法是取少量物质与试管中滴加石蕊试液,若溶液变为红色,说明该物质含有-COOH.
(3)写出下列反应的化学方程式并指出反应类型:
④
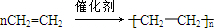 ,反应类型加聚反应.
,反应类型加聚反应.
分析 A是来自石油的重要有机化工原料,A得到的F是一种高聚物,可制成多种包装材料,A为乙烯,F为聚乙烯,B与D可以得到E,E是具有果香味的有机物,E为酯,故B为乙醇,D为乙酸,E为也实验装置,B催化氧化生成C,C为乙醛,据此解答.
解答 解:A是来自石油的重要有机化工原料,A得到的F是一种高聚物,可制成多种包装材料,A为乙烯,F为聚乙烯,B与D可以得到E,E是具有果香味的有机物,E为酯,故B为乙醇,D为乙酸,E为也实验装置,B催化氧化生成C,C为乙醛,
(1)由上述分析可知,A是乙烯,电子式为 ,
,
故答案为: ,;
,;
(2)D是乙酸,分子含有羧基,取少量物质与试管中滴加石蕊试液,若溶液变为红色,说明该物质含有-COOH
故答案为:羧基,取少量物质与试管中滴加石蕊试液,若溶液变为红色,说明该物质含有-COOH;
(3)反应④是乙烯发生加聚反应生成聚乙烯,反应方程式为: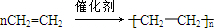 ,
,
故答案为: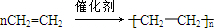 ,加聚反应.
,加聚反应.
点评 考查有机物的推断,涉及烯、醇、羧酸等性质与转化,难度不大,是对有机知识的总运用,有机推断是高考不变的一个题型,每年高考中必考,经常给出某反应信息要求学生加以应用,能较好的考查考生的阅读、自学能力和思维能力,是热点题型.

练习册系列答案
相关题目
2.有机物C4H9Cl有多少种同分异构体( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
13.下列对碱金属性质的叙述中,正确的是( )
| A. | 都是银白色的柔软金属,密度都比水小 | |
| B. | 单质在空气中燃烧生成的都是过氧化物 | |
| C. | 单质的熔沸点随着原子序数的增加而升高 | |
| D. | 碱金属单质与水剧烈反应生成碱和氢气 |
10.R、W、X、Y、Z为原子序数依次递增的11~18号元素中的五种元素,下列说法一定正确的是(m、n均为正整数)( )
| A. | 若R(OH)n为强碱,则W(OH)m也为强碱 | |
| B. | 若HnXOm为强酸,则Y是活泼的非金属元素 | |
| C. | 若Y的最低化合价是-2,则Z的最高正价为+6 | |
| D. | 若X的最高正价为+5,则五种元素都是非金属元素 |
7.某元素的一种同位素X的原子质量数为A,含N个中子,它与${\;}_{1}^{2}$H原子组成HmX分子,在agHmX中所含质子的物质的量是( )
| A. | $\frac{a}{A}$(A-N+2m)mol | B. | $\frac{a}{A+m}$(A-N)mol | C. | $\frac{a}{A+m}$(A-N+2m)mol | D. | $\frac{a}{A+2m}$(A-N+m)mol |
8.在白色点滴板上进行Na2SO3的性质实验探究.如图所示,a、b、c三个凹槽中滴有Na2SO3溶液,再分别滴加下图所示的试剂:
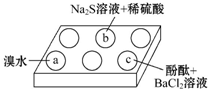
(1)a中实验现象是溴水褪色,该现象可证明Na2SO3具有还原性.
(2)b中发生反应的离子方程式是SO32-+2S2-+6H+=3S↓+3 H2O.
(3)应用化学平衡原理解释c中现象(用化学用语及简单文字表述)在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O?HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-═BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.
(4)在用NaOH溶液吸收SO2的过程中,往往得到Na2SO3和NaHSO3的混合溶液,溶液pH随n(SO32-):n(HSO3-)变化关系如下表:
①当吸收液中n(SO32-):n(HSO3-)=10:1时,溶液中离子浓度关系正确的是ac(选填编号).
a.c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)>c(H+)
c.c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
②若n(SO32-):n(HSO3-)=3:2,则0.8mol NaOH溶液吸收了标准状况下的SO211.2L.

(1)a中实验现象是溴水褪色,该现象可证明Na2SO3具有还原性.
(2)b中发生反应的离子方程式是SO32-+2S2-+6H+=3S↓+3 H2O.
(3)应用化学平衡原理解释c中现象(用化学用语及简单文字表述)在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O?HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-═BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.
(4)在用NaOH溶液吸收SO2的过程中,往往得到Na2SO3和NaHSO3的混合溶液,溶液pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
a.c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)>c(H+)
c.c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
②若n(SO32-):n(HSO3-)=3:2,则0.8mol NaOH溶液吸收了标准状况下的SO211.2L.
 .
.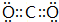 .
. .
.