题目内容
10. 碳及其化合物与人类生产、生活密切相关.
碳及其化合物与人类生产、生活密切相关.(1)在化工生产过程中,少量CO的存在会引起催化剂中毒,为了防止催化剂中毒,常用SO2将CO氧化,SO2被还原为S.
已知:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H1=-126.4kJ•mol-1
C(s)+O2(g)=CO2(g)△H2=-393.5kJ•mol-1
S(s)+O2(g)=SO2(g)△H3=-296.8kJ•mol-1
则SO2氧化CO的热化学反应方程式为SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-237.4kJ•mol-1.
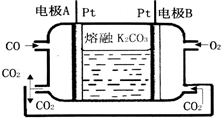
(2)一种新型CO燃料电池工作原理如图所示.
①负极电极反应式:CO+CO32--2e-=2CO2;正极电极反应式:O2+4e-+2CO2═2CO32-.
②电极A处产生的CO2有部分参与循环利用,其利用率为50%.
分析 (1)已知:①C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-126.4kJ/mol
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ•mol-1
③S(s)+O2(g)═SO2(g)△H3=-296.8kJ•mol-1
依据盖斯定律计算②×2-①×2-③得到答案;
(2)①负极是一氧化碳发生氧化反应,生成二氧化碳,电极反应2CO+2CO32--4e-=4CO2,而正极反应为:O2+4e-+2CO2═2CO32-;
②依据电极反应电子守恒计算.
解答 解:(1)已知:①C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-126.4kJ/mol
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ•mol-1
③S(s)+O2(g)═SO2(g)△H3=-296.8kJ•mol-1
依据盖斯定律计算②×2-①×2-③得到SO2氧化CO的热化学反应方程式:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-237.4kJ•mol-1;
故答案为:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-237.4kJ•mol-1;
(2)①负极是一氧化碳发生氧化反应,生成二氧化碳,电极反应式为:CO+CO32--2e-=2CO2,正极电极反应为:O2+4e-+2CO2═2CO32-,
故答案为:CO+CO32--2e-=2CO2;O2+4e-+2CO2═2CO32-;
②根据负极2CO+2CO32--4e-=4CO2,而正极反应为O2+4e-+2CO2═2CO32-,所以在转移4mol电子相同的情况下负极产生4mol的二氧化碳,而正极消耗2mol的二氧化碳,所以利用率为50%,故答案为:50%.
点评 本题目综合考查盖斯定律的应用、化学反应平衡常数的计算和应用等方面的知识,侧重于影响平衡移动及平衡常数的因素的考查,注意知识的归纳和整理是关键,题目难度中等.注意(2)燃料电池反应的特点.

| A. | $\frac{A(A-x+n)}{W}mol$ | B. | $\frac{w(A+x-n)}{A}mol$ | C. | $\frac{w(A-x+n)}{A}mol$ | D. | $\frac{w(A-X-N)}{A}mol$ |
| A. | 0.2 mol | B. | 0.5mol | C. | 1mol | D. | 2mol |
| A. | 放电时,LiMn2O4发生氧化反应 | |
| B. | 放电时,正极反应为:Li++LiMn2O4+e-═Li2Mn2O4 | |
| C. | 充电时,LiMn2O4发生氧化反应 | |
| D. | 充电时,阳极反应为:Li++e-═Li |
 的说法中不正确的是( )
的说法中不正确的是( )| A. | 不能发生消去反应 | |
| B. | 所有的碳原子在同一个平面上 | |
| C. | 能够发生加成反应 | |
| D. | 水解生成的有机物可与NaOH溶液反应 |
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
| A. | $\frac{a}{A}$(A-N+2m)mol | B. | $\frac{a}{A+m}$(A-N)mol | C. | $\frac{a}{A+m}$(A-N+2m)mol | D. | $\frac{a}{A+2m}$(A-N+m)mol |
 .
. .
. .
.