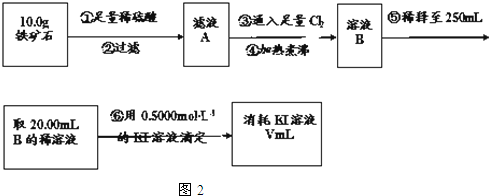
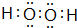题目内容
11.下列反应中,调节反应物用量或浓度不会改变反应产物的是( )| A. | 钠在氧气中燃烧 | B. | NaOH溶液滴入NH4HCO3溶液 | ||
| C. | 稀硝酸中加入铁粉 | D. | 镁与H2SO4溶液 |
分析 A、金属钠在氧气中燃烧生成过氧化钠;
B、NaOH溶液滴入NH4HCO3溶液,如果氢氧化钠少量只与碳酸氢根离子反应,如果氢氧化钠过量既与碳酸氢根离子又与铵根离子反应;
C、Fe与稀硝酸反应,硝酸过量反应生成硝酸铁,硝酸不足生成硝酸亚铁;
D、镁与浓硫酸反应生成二氧化硫,与稀硫酸反应生成氢气.
解答 解:A、金属钠在氧气中燃烧生成过氧化钠,产物与反应物用量无关,故A选;
B、NaOH溶液滴入NH4HCO3溶液,如果氢氧化钠少量只与碳酸氢根离子反应,如果氢氧化钠过量既与碳酸氢根离子又与铵根离子反应,所以与用量有关,故B不选;
C、Fe与稀硝酸反应,硝酸过量反应生成硝酸铁,硝酸不足生成硝酸亚铁,产物与硝酸的用量有关,故C不选;
D、镁与浓硫酸反应生成二氧化硫,与稀硫酸反应生成氢气,所以产物与用量有关,故D不选;
故选A.
点评 本题考查量不同,反应产物不同,此题是对物质之间反应物量的不同导致的结果不同的考查,熟悉物质的性质和反应的实质是解题关键,题目难度不大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
1.短周期元素X和元素Y位于不同的周期,元素X原子的最外层电子数为a,次外层电子数为b;元素Y原子的M层电子数为(a-b),L层电子数为(a+b),则关于X、Y两元素形成的化合物的说法正确的是( )
| A. | 属于两性氧化物 | B. | 能与氢氧化钠反应 | ||
| C. | 能与硫酸反应 | D. | 常温下能溶于水 |
2.用中和滴定法测定烧碱的纯度(烧碱中的杂质不和酸反应),请根据实验回答:
(1)将称量好的4.3g烧碱样品配制成250mL待测液,配制过程使用的主要仪器除250mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是玻璃棒.
(2)用碱式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞.
(3)用0.20mol•L-1的标准盐酸滴定待测液,判断滴定终点的现象是:滴入最后一滴盐酸时,锥形瓶内溶液恰好由红色变无色,并且半分钟内不变色.
(4)如果实验操作正确,从滴定开始到结束,溶液中的离子浓度关系可以出现的是B、C(填答案字母序号)
A.c(Na+)>c(Cl-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(Cl-)>c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(Cl-)
D.c(Na+)+c(H+)>c(OH-)+c(Cl-)
(5)根据下列数据计算,c(NaOH)=0.40mol/L,烧碱的纯度为93%(保留整数)
(6)经过分析发现,本次实验的测定结果比烧碱的实际纯度偏高,造成误差的可能原因是C、D(填答案字母序号)
A.滴定前平视,滴定后俯视 B.用标准液润洗滴定管
C.用待测液润洗锥形瓶 D.不小心将标准液滴在锥形瓶外面
E.滴定接近终点时,用少量蒸馏水冲洗锥形瓶内.
(1)将称量好的4.3g烧碱样品配制成250mL待测液,配制过程使用的主要仪器除250mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是玻璃棒.
(2)用碱式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞.
(3)用0.20mol•L-1的标准盐酸滴定待测液,判断滴定终点的现象是:滴入最后一滴盐酸时,锥形瓶内溶液恰好由红色变无色,并且半分钟内不变色.
(4)如果实验操作正确,从滴定开始到结束,溶液中的离子浓度关系可以出现的是B、C(填答案字母序号)
A.c(Na+)>c(Cl-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(Cl-)>c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(Cl-)
D.c(Na+)+c(H+)>c(OH-)+c(Cl-)
(5)根据下列数据计算,c(NaOH)=0.40mol/L,烧碱的纯度为93%(保留整数)
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
A.滴定前平视,滴定后俯视 B.用标准液润洗滴定管
C.用待测液润洗锥形瓶 D.不小心将标准液滴在锥形瓶外面
E.滴定接近终点时,用少量蒸馏水冲洗锥形瓶内.
19.碳酸锂是重要的锂化合物,是制备其它高纯锂化合物的重要原料.我国锂资源储量非常丰富,其中卤水锂资源约占其中的79%,由盐湖卤水(主要含有:LiCl、MgCl2、Na2B4O7等) 制备碳酸锂,其工艺流程如下:
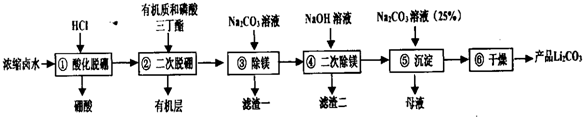
己知:
I、盐卤中的硼元素以Na2B4O7形式存在,硼酸(H3BO3)常温时在水中溶解度不大
Ⅱ、LiOH易溶于水
Ⅲ、
(1)写出①过程的离子方程式B4O72-+2H++5H2O=4H3BO3↓.
(2)②过程中的操作名称是萃取反应,在所得有机层中加入0.25mol/LNaOH溶液可以再生有机质和磷酸三丁酯,但不能加浓NaOH溶液,其原因是避免氢氧化钠溶液浓度过大使磷酸三丁酯水解.
(3)③过程结束后,溶液中C(Li+)=5mol/L,若此过程中不产生Li2CO3沉淀,则此时溶液中镁离子的物质的量浓度不小于0.21mol/L.
(4)滤渣一,滤渣二的主要成分分别是MgCO3、Mg(OH)2.
(5)如何检验第⑤步中Li+是否沉淀完全取少量上层清液于试管中,继续加入碳酸钠溶液若无沉淀出现,则沉淀完全.
(6)髙纯度的碳酸锂可以用于制备锂离子电池的正极材料.如LiCoO2可以采用下面方法制备:将Li2CO3与CoCO3按1:1的比例混合,再在空气中灼烧即可,试写出该反应的化学方程式2Li2CO3+4CoCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$4LiCoO2+6CO2.
一种钻酸锂电池的工作原理如下:LixC6+Li1-xCoO2=LiCoO2+C6,该电池在充电时负极上发生的电极反应为xLi++xe-+C6=LixC6.

己知:
I、盐卤中的硼元素以Na2B4O7形式存在,硼酸(H3BO3)常温时在水中溶解度不大
Ⅱ、LiOH易溶于水
Ⅲ、
| 物质 | MgCO3 | Li2CO3 | Mg(OH)2 |
| Ksp | 6.82×10-6 | 8.2×10-4 | 5.6×10-12 |
(2)②过程中的操作名称是萃取反应,在所得有机层中加入0.25mol/LNaOH溶液可以再生有机质和磷酸三丁酯,但不能加浓NaOH溶液,其原因是避免氢氧化钠溶液浓度过大使磷酸三丁酯水解.
(3)③过程结束后,溶液中C(Li+)=5mol/L,若此过程中不产生Li2CO3沉淀,则此时溶液中镁离子的物质的量浓度不小于0.21mol/L.
(4)滤渣一,滤渣二的主要成分分别是MgCO3、Mg(OH)2.
(5)如何检验第⑤步中Li+是否沉淀完全取少量上层清液于试管中,继续加入碳酸钠溶液若无沉淀出现,则沉淀完全.
(6)髙纯度的碳酸锂可以用于制备锂离子电池的正极材料.如LiCoO2可以采用下面方法制备:将Li2CO3与CoCO3按1:1的比例混合,再在空气中灼烧即可,试写出该反应的化学方程式2Li2CO3+4CoCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$4LiCoO2+6CO2.
一种钻酸锂电池的工作原理如下:LixC6+Li1-xCoO2=LiCoO2+C6,该电池在充电时负极上发生的电极反应为xLi++xe-+C6=LixC6.
3.25℃时,下列无色溶液中由水电离产生的H+是1×10-5mol/L的且能大量共存的是( )
| A. | K+、Na+、NO3-、SO42- | B. | Mg2+、K+、NO3-、Cl- | ||
| C. | Na+、Fe2+、NO3-、Cl- | D. | Ba2+、H+、Cl-、SO42- |
20.某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,则w克这种元素的原子核内中子的物质的量为( )
| A. | $\frac{A(A-x+n)}{W}mol$ | B. | $\frac{w(A+x-n)}{A}mol$ | C. | $\frac{w(A-x+n)}{A}mol$ | D. | $\frac{w(A-X-N)}{A}mol$ |
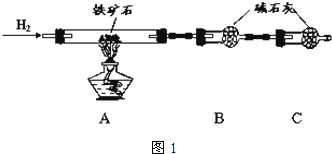 铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应).某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究.
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应).某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究.