题目内容
12.认真观察下列装置,下列说法错误的是( )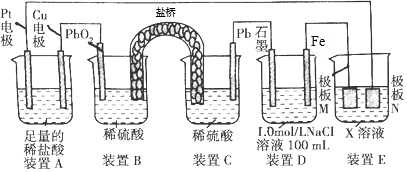
| A. | 装置B中PbO2上发生的电极反应方程式为:PbO2+4H++SO42-+2e-═PbSO4+2H2O | |
| B. | 装置A中总反应的离子方程式为:Cu+2H+$\frac{\underline{\;通电\;}}{\;}$Cu2++H2↑ | |
| C. | 若装置E的目的是在Cu材料上镀银,则极板N的材料为Cu | |
| D. | 若在装置D中生成0.2molFe(OH)3,则消耗水的物质的量共为0.5mol |
分析 A、B、C装置是含盐桥的原电池装置,PbO2是正极发生还原反应;
B、铜与原电池的正极相连是阳极,发生氧化反应;
C、N是阳极,阳极应是镀层金属银;
D、得到0.2molFe(OH)3沉淀,涉及反应有Fe+2H2O=Fe(OH)2+H2↑,4Fe(OH)2+O2+2H2O=4Fe(OH)3,关系式为4Fe~10H2O,由此解答.
解答 解:A、B、C装置是含盐桥的原电池装置,PbO2是正极发生还原反应,电极反应式为:PbO2+4H++SO42-+2e-═PbSO4+2H2O,故A正确;
B、铜与原电池的正极相连是阳极,发生氧化反应,所以阳极铜本身放电生成铜离子,阴极是酸电离出的氢离子放电,生成氢气,总的电极反应式为:Cu+2H+$\frac{\underline{\;通电\;}}{\;}$Cu2++H2↑,故B正确;
C、N是阳极,阳极应是镀层金属银,所以极板M的材料为Cu,故C错误;
D、得到0.2molFe(OH)3沉淀,涉及反应有Fe+2H2O=Fe(OH)2+H2↑,4Fe(OH)2+O2+2H2O=4Fe(OH)3,关系式为4Fe~10H2O,
则得到0.2molFe(OH)3沉淀消耗0.5mol水,故D正确;
故选C.
点评 本题考查电解原理,电解池是历年高考常考知识点,注重考查学生分析问题、解决问题的能力,近年来常以新型电解池进行考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.反应A+3B=2C+D在四种不同情况下的反应速率,其中最快的是( )
| A. | V(A)=0.15mol/(L•s) | B. | V(B)=0.6mol/(L•s) | C. | V(C)=0.5mol/(L•s) | D. | V(D)=0.45mol/(L•s) |
7.如图所示的装置中,金属片紧靠贴着滤纸,下列判断错误的是( )


| A. | 两处的锌片均发生氧化反应 | |
| B. | 左侧铜片上的电极反应为2H2O+O2+4e-═4OH- | |
| C. | 阳离子移动方向分别由②→①、③→④ | |
| D. | 最先观察到红色的区域是④ |
17.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1mol 乙酸(忽略挥发损失)与足量的C2H5${\;}_{\;}^{18}$OH在浓硫酸作用下加热,充分反应可生成NA个CH3CO${\;}_{\;}^{18}$OC2H5分子 | |
| B. | 常温常压下,7.8gNa2O2含离子数为 0.4NA | |
| C. | 标准状况下,11.2LCCl4 中含分子数为 0.5NA | |
| D. | 6.4gO2和O3 的混合气体,含氧原子数为 0.4NA |
4.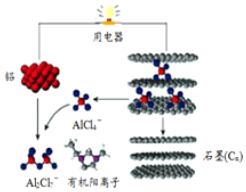 一种能快速充电的超常性能电池-铅离子电池.或许能更好的解决电网电力的存储、协调、平衡问题.该电池由A1Cl${\;}_{4}^{-}$、A12Cl${\;}_{7}^{-}$i以及有机阳离子组成电解质溶液.放电时的工作原理如图所示.下列观点正确的是( )
一种能快速充电的超常性能电池-铅离子电池.或许能更好的解决电网电力的存储、协调、平衡问题.该电池由A1Cl${\;}_{4}^{-}$、A12Cl${\;}_{7}^{-}$i以及有机阳离子组成电解质溶液.放电时的工作原理如图所示.下列观点正确的是( )
 一种能快速充电的超常性能电池-铅离子电池.或许能更好的解决电网电力的存储、协调、平衡问题.该电池由A1Cl${\;}_{4}^{-}$、A12Cl${\;}_{7}^{-}$i以及有机阳离子组成电解质溶液.放电时的工作原理如图所示.下列观点正确的是( )
一种能快速充电的超常性能电池-铅离子电池.或许能更好的解决电网电力的存储、协调、平衡问题.该电池由A1Cl${\;}_{4}^{-}$、A12Cl${\;}_{7}^{-}$i以及有机阳离子组成电解质溶液.放电时的工作原理如图所示.下列观点正确的是( )| A. | 该电池充电时的电子流向为:铝→用电器→石墨(C) | |
| B. | 该电池放电时石墨电极发生氧化反应 | |
| C. | 充电时的阴极反应为:4Al2Cl7-+3e-═Al+7AlCl4- | |
| D. | 放电时,有机阳离子向铝电极方向移动 |
1.下列装置能达到实验目的是( )
| A. |  用于分离酒精和水 | |
| B. |  用于验证木炭与浓硫酸的反应产物中含有CO2 | |
| C. |  用于除去CO2中的少量HCl | |
| D. |  用于制备蒸馏水 |
2.下列叙述错误的是( )
| A. | 用丁达尔现象区分溶液与胶体 | |
| B. | 用蒸馏的方法除去自来水中含有的Cl- | |
| C. | 用萃取的方法从某些植物中提取香料或中药成份 | |
| D. | 金属钠长期暴露在空气中的最终产物是NaHCO3 |