题目内容
3.下列各组物质的分离或提纯,应选用下述方法的哪一种(填序号).A.重结晶 B.盐析 C.色谱法D.分液 E.蒸馏 F.渗析
(1)用饱和碳酸钠溶液除去乙酸乙酯中的乙酸和乙醇等杂质D;
(2)从乙醇的水溶液中提取乙醇E;
(3)除去淀粉胶体中的氯化钠F.
(4)除去硝酸钾固体中的少量氯化钠A.
(5)提纯蛋白质溶液B.
(6)用粉笔分离菠菜叶中的色素C.
分析 (1)饱和碳酸钠吸收乙醇、乙酸后,与乙酸乙酯分层;
(2)乙醇与水互溶,但沸点不同;
(3)淀粉不能透过半透膜,而溶液可以;
(4)二者溶解度受温度影响不同;
(5)食盐可降低蛋白质的溶解度,发生盐析;
(6)粉笔分离菠菜叶中的色素,为色谱法.
解答 解:(1)饱和碳酸钠吸收乙醇、乙酸后,与乙酸乙酯分层,选分液法分离,故答案为:D;
(2)乙醇与水互溶,但沸点不同,选择蒸馏法,故答案为:E;
(3)淀粉不能透过半透膜,而溶液可以,选渗析法分离,故答案为:F;
(4)二者溶解度受温度影响不同,选择结晶法分离,故答案为:A;
(5)提纯蛋白质溶液,选择盐析法,故答案为:B;
(6)粉笔分离菠菜叶中的色素,选择色谱法,故答案为:C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意分离原理及方法选择,题目难度不大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
18. 某学生在A、B两个装置的气球中分别装入1.06g Na2CO3和0.84g NaHCO3,试管中是足量的等浓度、等体积的盐酸,将两气球中物质同时倒入试管中完全反应.有关现象描述不正确的是(假设反应前后溶液体积不变)( )
某学生在A、B两个装置的气球中分别装入1.06g Na2CO3和0.84g NaHCO3,试管中是足量的等浓度、等体积的盐酸,将两气球中物质同时倒入试管中完全反应.有关现象描述不正确的是(假设反应前后溶液体积不变)( )
 某学生在A、B两个装置的气球中分别装入1.06g Na2CO3和0.84g NaHCO3,试管中是足量的等浓度、等体积的盐酸,将两气球中物质同时倒入试管中完全反应.有关现象描述不正确的是(假设反应前后溶液体积不变)( )
某学生在A、B两个装置的气球中分别装入1.06g Na2CO3和0.84g NaHCO3,试管中是足量的等浓度、等体积的盐酸,将两气球中物质同时倒入试管中完全反应.有关现象描述不正确的是(假设反应前后溶液体积不变)( )| A. | 起初A气球鼓胀速度快,最终B气球大 | |
| B. | 起初B气球鼓胀速度快,最终两气球一样大 | |
| C. | 最终两溶液中氯离子物质的量浓度相同 | |
| D. | 最终两溶液中钠离子物质的量浓度不同 |
14.下列有机物命名正确的是( )
| A. |  1,3,4-三甲苯 1,3,4-三甲苯 | B. |  2-甲基戊烷 2-甲基戊烷 | ||
| C. |  2-甲基-1-丙醇 2-甲基-1-丙醇 | D. |  2-甲基-3-丁炔 2-甲基-3-丁炔 |
11.可逆反应N2(g)+3H2(g)?2NH3(g)在一定条件下于1L的密闭容器中发生,若开始时加入1mol N2、4mol H2、2mol NH3,反应达到平衡 时各组分的浓度可能达到的值是( )( )
| A. | c(N2)2 mol/L | B. | c(N2)0 mol/L | C. | c(H2)1 mol/L | D. | c(NH3)2.5 mol/L |
8.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 12gC-13含有的原子数为NA | |
| B. | 28gCO和44gCO2含有的氧原子数均为NA | |
| C. | 1.7gH2O2中含有的电子数为0.9NA | |
| D. | 标准状况下,2.24LH2O所含分子数为0.1NA |
15.常温下,下列各组比值为1:2的是( )
| A. | 0.1mol•L-1与0.2mol•L-1醋酸溶液,c(H+)之比 | |
| B. | 0.1mol•L-1Na2HPO4溶液,c(HPO42-)与c(Na+)之比 | |
| C. | pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比 | |
| D. | pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比 |
12.认真观察下列装置,下列说法错误的是( )
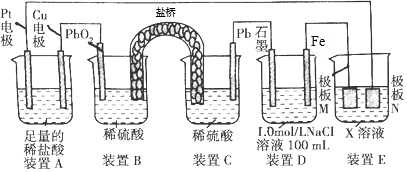

| A. | 装置B中PbO2上发生的电极反应方程式为:PbO2+4H++SO42-+2e-═PbSO4+2H2O | |
| B. | 装置A中总反应的离子方程式为:Cu+2H+$\frac{\underline{\;通电\;}}{\;}$Cu2++H2↑ | |
| C. | 若装置E的目的是在Cu材料上镀银,则极板N的材料为Cu | |
| D. | 若在装置D中生成0.2molFe(OH)3,则消耗水的物质的量共为0.5mol |
13.一定条件下,对于可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断正确的是( )
| A. | X、Y的转化率相等 | |
| B. | 在恒温恒压条件下,达到平衡后充入Y气体,则平衡正向移动 | |
| C. | 平衡时,Y和Z的生成速率之比为2:3 | |
| D. | c1的取值范围为0.04 mol/L<c1<0.14 mol/L |