题目内容
4.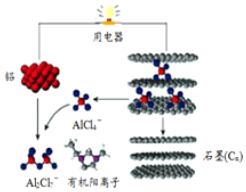 一种能快速充电的超常性能电池-铅离子电池.或许能更好的解决电网电力的存储、协调、平衡问题.该电池由A1Cl${\;}_{4}^{-}$、A12Cl${\;}_{7}^{-}$i以及有机阳离子组成电解质溶液.放电时的工作原理如图所示.下列观点正确的是( )
一种能快速充电的超常性能电池-铅离子电池.或许能更好的解决电网电力的存储、协调、平衡问题.该电池由A1Cl${\;}_{4}^{-}$、A12Cl${\;}_{7}^{-}$i以及有机阳离子组成电解质溶液.放电时的工作原理如图所示.下列观点正确的是( )| A. | 该电池充电时的电子流向为:铝→用电器→石墨(C) | |
| B. | 该电池放电时石墨电极发生氧化反应 | |
| C. | 充电时的阴极反应为:4Al2Cl7-+3e-═Al+7AlCl4- | |
| D. | 放电时,有机阳离子向铝电极方向移动 |
分析 由示意图可知放电时铝为负极,被氧化生成Al2Cl7-,电极方程式为Al+7AlCl4--3e-═4Al2Cl7-,正极反应为3Cn[AlCl4]+3e-=3Cn+3AlCl4-,电解时阳极发生氧化反应,电解方程式为Cn+AlCl4--e-═Cn[AlCl4],阴极发生还原反应,电极方程式为4Al2Cl7-+3e-=Al+7AlCl4-,以此解答该题.
解答 解:A、该电池充电时是电解池,而放电是原电池,所以放电时电子流向为:铝→用电器→石墨(C),故A错误;
B、该电池放电时石墨是正极,电极发生还原反应,故B错误;
C、放电时负极发生氧化反应生成铝离子,铝离子与AlCl4-结合生成Al2Cl7-,所以电极反应式为:Al-3e-+7AlCl4-═4Al2Cl7-,所以充电时的阴极反应为:4Al2Cl7-+3e-═Al+7AlCl4-,故C正确;
D、原电池中阳离子向正极移动,所以有机阳离子向石墨电极方向移动,故D错误.
故选C.
点评 本题考查学生二次电池的工作原理以及原电池和电解池的工作原理知识,为高频考点,侧重学生的分析能力的考查,属于综合知识的考查,难度中等,注意把握电极的判断方法和电极方程式的书写.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
14.下列有机物命名正确的是( )
| A. |  1,3,4-三甲苯 1,3,4-三甲苯 | B. |  2-甲基戊烷 2-甲基戊烷 | ||
| C. |  2-甲基-1-丙醇 2-甲基-1-丙醇 | D. |  2-甲基-3-丁炔 2-甲基-3-丁炔 |
15.常温下,下列各组比值为1:2的是( )
| A. | 0.1mol•L-1与0.2mol•L-1醋酸溶液,c(H+)之比 | |
| B. | 0.1mol•L-1Na2HPO4溶液,c(HPO42-)与c(Na+)之比 | |
| C. | pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比 | |
| D. | pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比 |
12.认真观察下列装置,下列说法错误的是( )


| A. | 装置B中PbO2上发生的电极反应方程式为:PbO2+4H++SO42-+2e-═PbSO4+2H2O | |
| B. | 装置A中总反应的离子方程式为:Cu+2H+$\frac{\underline{\;通电\;}}{\;}$Cu2++H2↑ | |
| C. | 若装置E的目的是在Cu材料上镀银,则极板N的材料为Cu | |
| D. | 若在装置D中生成0.2molFe(OH)3,则消耗水的物质的量共为0.5mol |
19.下列化学用语错误的是( )
| A. | 氯化氢分子的电子式: | B. | 乙烯的结构简式:CH2=CH2 | ||
| C. | 苯的分子式:C6H6 | D. | 氯的原子结构示意图: |
9.下列有机物名称中,正确的是( )
①3,3-二甲基戊烷 ②2,3-二甲基-2-乙基丁烷
③3-乙基戊烷 ④2,5,5-三甲基己烷.
①3,3-二甲基戊烷 ②2,3-二甲基-2-乙基丁烷
③3-乙基戊烷 ④2,5,5-三甲基己烷.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | 都错误 |
16.下列化学反应表达错误的是( )
| A. | CH2=CH2+HBr $\stackrel{催化剂}{→}$CH3CH2Br | |
| B. | CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOC2H5 | |
| C. |  | |
| D. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O |
13.一定条件下,对于可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断正确的是( )
| A. | X、Y的转化率相等 | |
| B. | 在恒温恒压条件下,达到平衡后充入Y气体,则平衡正向移动 | |
| C. | 平衡时,Y和Z的生成速率之比为2:3 | |
| D. | c1的取值范围为0.04 mol/L<c1<0.14 mol/L |
9.电离平衡常数是衡量弱电解质电离程度的量.已知如下表数据(25℃):
(1)25℃时,等浓度的三种溶液(A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液)的pH由大到小的顺序为b>a>c.(填写序号)
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+CO2+H2O=NaHCO3+HCN.
(3)现有浓度为0.02mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是BD.
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(H+)+c(HCN)=c(OH-)
D.c(HCN)+c(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+CO2+H2O=NaHCO3+HCN.
(3)现有浓度为0.02mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是BD.
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(H+)+c(HCN)=c(OH-)
D.c(HCN)+c(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).