题目内容
20. 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.Ⅰ.硫酸具有多种性质,热的浓硫酸与铜片反应体现出浓硫酸的性质是酸性和强氧化性
Ⅱ.现用该浓硫酸准确配制100mL 1mol/L的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.
请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有②④⑥(填序号),还缺少的仪器有100mL容量瓶 玻璃棒(写仪器名称);
(2)经计算,配制100mL 1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为5.4mL(保留一位小数),量取浓硫酸时应选用①(①10mL、②50mL、③100mL)规格的量筒.
分析 Ⅰ.依据铜与浓硫酸反应生成硫酸铜、二氧化硫和水反应中硫元素化合价变化判断;
Ⅱ.(1)依据配制一定物质的量浓度溶液一般步骤选择需要仪器;
(2)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸体积,据此选择合适的量筒.
解答 解:Ⅰ.铜与浓硫酸反应生成硫酸铜、二氧化硫和水,反应中硫酸中的硫元素部分化合价降低,部分化合价不变,所以表现了浓硫酸强的氧化性和酸性;
故答案为;酸性和强氧化性;
Ⅱ.(1)配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容等,用到的仪器:量筒、玻璃棒、烧杯、100mL容量瓶、胶头滴管,所以不需要使用的有烧瓶、药匙、托盘天平;还缺少的仪器:100mL容量瓶 玻璃棒;
故答案为:②④⑥; 100mL容量瓶 玻璃棒;
(2)浓硫酸的物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:V×18.4mol/L=100mL×1mol/L,解得V=5.4mL,所以应选择10mL量筒;
故答案为:5.4;①.
点评 本题考查了浓硫酸的性质及配制一定物质的量浓度的溶液,熟悉硫酸的性质,明确配制过程及操作步骤是解题关键,注意量筒、容量瓶规格选择方法,题目难度不大.

练习册系列答案
相关题目
10.下列事实不能用勒夏特列原理解释的是( )
| A. | 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 | |
| B. | 在沸腾的蒸馏水中滴加饱和FeCl3溶液,制Fe(OH)3胶体 | |
| C. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫 | |
| D. | 用排饱和食盐水的方法收集氯气 |
11.下列有关反应的离子方程式书写正确的是( )
| A. | 用铁片与稀盐酸制取H2:2Fe+6H+═2Fe3++3H2↑ | |
| B. | HNO3溶液中加入NaOH溶液:H++OH-═H2O | |
| C. | 向硫酸铁溶液中加入铁钉:Fe3++Fe═2Fe2+ | |
| D. | 向AlCl3溶液中加入过量NH3•H2O:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
8.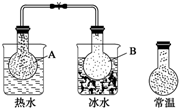 已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )
已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )
 已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )
已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )| A. | 反应2NO2(g)?N2O4(g)的正反应为吸热反应 | |
| B. | 上述过程中,A烧瓶内正、逆反应速率均加快 | |
| C. | 上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大 | |
| D. | 上述过程中,A、B烧瓶内气体密度均保持不变 |
15.某水溶液只可能含有K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-中的若干种离子.某同学取100mL的溶液分成两等份进行如下实验:
①第一份加过量的氢氧化钠溶液后加热,收集到0.02mol的气体,无沉淀产生,同时得到溶液甲.
②向溶液甲中通过量的二氧化碳气体,生成白色沉淀,沉淀经过滤,洗涤灼烧后,得到1.02g固体.
③第二份加足量的氯化钡溶液后,生成白色沉淀,沉淀经盐酸充分洗涤,干燥,得到11.65g固体.
据此,该同学得到的结论正确的是( )
①第一份加过量的氢氧化钠溶液后加热,收集到0.02mol的气体,无沉淀产生,同时得到溶液甲.
②向溶液甲中通过量的二氧化碳气体,生成白色沉淀,沉淀经过滤,洗涤灼烧后,得到1.02g固体.
③第二份加足量的氯化钡溶液后,生成白色沉淀,沉淀经盐酸充分洗涤,干燥,得到11.65g固体.
据此,该同学得到的结论正确的是( )
| A. | 实验①中产生的气体为氨气,并可得原溶液中c(NH4+)=0.1 mol•L-1 | |
| B. | 实验③中的沉淀中一定有BaSO4,可能有Mg(OH)2 | |
| C. | 若要判断原溶液中是否有Cl-,无需另外设计实验验证 | |
| D. | 原溶液中一定有K+,且c(K+)≥0.4 mol•L-1 |
5.下列溶液中能够区别SO2和CO2气体的是( )
①澄清石灰水 ②H2S溶液 ③KMnO4酸性溶液 ④NaHCO3溶液 ⑤品红溶液.
①澄清石灰水 ②H2S溶液 ③KMnO4酸性溶液 ④NaHCO3溶液 ⑤品红溶液.
| A. | 只有①②③ | B. | 只有②③⑤ | C. | ②③④⑤ | D. | ①②③⑤ |
9.根据下图所示的装置,判断下列说法正确的是( )
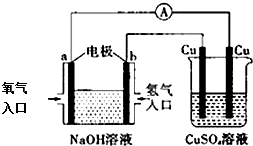

| A. | 该装置中a极为负极 | |
| B. | 该装置中b极的电极反应式是:2H++2e-=H2↑ | |
| C. | 一段时间后,左边装置中溶液pH增大 | |
| D. | CuSO4溶液浓度保持不变 |
10.下列操作不能达到目的是( )
| 选项 | 目的 | 操作 |
| A | 配制80mL 1.0mol•L-1CuSO4溶液 | 将25g CuSO4•5H2O溶于蒸馏水配制成100mL溶液 |
| B | 除去KCl中少量KClO3 | 将混合物(加少量MnO2)置于坩埚中灼烧至固体质量不再减少 |
| C | 在溶液中将MnO4-完全转化为Mn2+ | 向酸性KMnO4溶液中滴加H2O2溶液至紫色消失 |
| D | 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
 ;
;