题目内容
8.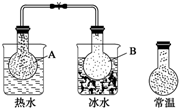 已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )
已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )| A. | 反应2NO2(g)?N2O4(g)的正反应为吸热反应 | |
| B. | 上述过程中,A烧瓶内正、逆反应速率均加快 | |
| C. | 上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大 | |
| D. | 上述过程中,A、B烧瓶内气体密度均保持不变 |
分析 A.放在热水中的A烧瓶内气体颜色变深,放在冰水中的B烧瓶内气体颜色变浅,说明升高温度平衡向生成NO2,降低温度平衡向生成N2O4方向移动;
B.升高温度,正、逆反应速率都增大;
C.B烧瓶内气体颜色变浅,说明平衡向生成N2O4方向移动;
D.容器的容积不变,混合气体的质量不变,结合ρ=$\frac{m}{V}$判断.
解答 解:A.放在热水中的A烧瓶内气体颜色变深,放在冰水中的B烧瓶内气体颜色变浅,说明升高温度平衡向生成NO2,降低温度平衡向生成N2O4方向移动,故反应2NO2(g)?N2O4(g)的正反应为放热反应,故A错误;
B.升高温度,正、逆反应速率都加快,故B正确;
C.B烧瓶内气体颜色变浅,说明平衡向生成N2O4方向移动,B烧瓶内c(NO2)减小,c(N2O4)增大,故C正确;
D.容器的容积不变,混合气体的质量不变,由ρ=$\frac{m}{V}$可知,A烧瓶、B烧瓶内气体密度都不变,故D正确,
故选A.
点评 本题考查化学平衡的影响因素,难度不大,根据不同温度下颜色变化判断平衡移动方向是关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.两种金属混合物共15g,投入足量的盐酸中,充分反应得11.2L H2(标准状况),则原混合物组成中肯定不能为下列的( )
| A. | Mg、Ag | B. | Fe、Zn | C. | Al、Fe | D. | Mg、Fe |
3.研究硫元素及其化合物的性质具有重要意义.
(1)①硫离子的结构示意图为 .
.
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)25℃,两种酸的电离平衡常数如下表:
①HSO3-的电离平衡常数表达式K=$\frac{c(S{{O}_{3}}^{2-})c({H}^{+})}{c(HS{{O}_{3}}^{-})}$.
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液反应的离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
(1)①硫离子的结构示意图为
 .
.②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)25℃,两种酸的电离平衡常数如下表:
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液反应的离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
17.下列说法不正确的是( )
①质子数相同的粒子一定属于同一种元素②同位素的性质完全相同③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子④电子数相同的粒子不一定是同一种元素⑤一种元素只能有一种质量数.
①质子数相同的粒子一定属于同一种元素②同位素的性质完全相同③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子④电子数相同的粒子不一定是同一种元素⑤一种元素只能有一种质量数.
| A. | ②③⑤ | B. | ①②④⑤ | C. | ①②⑤ | D. | ③④⑤ |
18.下列关于苯酚的叙述中,正确的是( )
| A. | 苯酚呈弱酸性,能使石蕊试液显浅红色 | |
| B. | 苯酚分子中的13个原子有可能处于同一平面上 | |
| C. | 苯酚可以和硝酸发生加成反应 | |
| D. | 苯酚能与FeCl3溶液反应生成紫色沉淀 |
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.