题目内容
18.蓄电池是一种可以反复充电、放电的装置,有一种蓄电池在充电(电解池)和放电(原电池)时发生的反应是NiO2+Fe+2H2O$?_{充电}^{放电}$ Fe(OH)2+Ni(OH)2,用该蓄电池电解(阴、阳极均为惰性电极)M(NO3)x溶液时,若此蓄电池工作一段时间后消耗0.36g 水.电解M(NO3)x溶液时某一极质量增加m g,金属M的相对原子质量(用m、x表示)的计算式为( )| A. | 20mx | B. | 20x/m | C. | 25mx | D. | 50m/x |
分析 电解M(NO3)x溶液时某一极质量增至m g,则Mx++xe-=M,n(H2O)=$\frac{0.36g}{18g/mol}$=0.02mol,发生2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑~4e-,由电子守恒可知,存在xH2O~2M,以此来解答.
解答 解:电解M(NO3)x溶液时某一极质量增至m g,则Mx++xe-=M,n(H2O)=$\frac{0.36g}{18g/mol}$=0.02mol,发生2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑~4e-,由电子守恒可知,存在xH2O~2M,n(M)=0.02mol×$\frac{2}{x}$=$\frac{0.04}{x}$mol,金属M的相对原子质量为$\frac{m}{\frac{0.04}{x}}$=25mx,
故选C.
点评 本题考查电化学反应的计算,为高频考点,把握发生的电极反应、电解反应为解答的关键,侧重分析与计算能力的考查,注意电子守恒的应用,题目难度不大.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
13.等物质的量的下列有机物,在相同条件下完全燃烧,耗氧量最多的是( )
| A. | C5H6 | B. | C4H6 | C. | C4H8O | D. | C5H6O2 |
3.已知下列两个气态物质之间的反应:C2H2(g)+H2(g)?C2H4(g) ①
2CH4(g)?C2H4(g)+2H2(g) ②
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:(Q1、Q2、Q3均为正值)
C(s)+2H2(g)?CH4 (g)△H=-Q1Ⅰ
C(s)+H2(g)═C2H2(g)△H=-Q2Ⅱ
C(s)+H2(g)═$\frac{1}{2}$C2H4(g)△H=-Q3Ⅲ
Q值大小比较正确的是( )
2CH4(g)?C2H4(g)+2H2(g) ②
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:(Q1、Q2、Q3均为正值)
C(s)+2H2(g)?CH4 (g)△H=-Q1Ⅰ
C(s)+H2(g)═C2H2(g)△H=-Q2Ⅱ
C(s)+H2(g)═$\frac{1}{2}$C2H4(g)△H=-Q3Ⅲ
Q值大小比较正确的是( )
| A. | Q1>Q3>Q2 | B. | Q1>Q2>Q3 | C. | Q2>Q1>Q3 | D. | Q3>Q1>Q2 |
7.下列根据实验操作或现象得出的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | KBrO3溶液中加入少量苯,然后通入少量Cl2,有机相呈橙色 | 氧化性:Cl2>Br2 |
| B | 室温下,向浓度均为0.1moL•L-1的KCl和KI混合溶液中滴加几滴AgNO3溶液,只出现黄色沉淀 | Ksp(AgI)>Ksp(AgCl) |
| C | 向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡后再加入0.5mL有机物Y,加热,未出现砖红色沉淀 | Y中不含有醛基 |
| D | 已知NaAlO2溶液的pH>7,将其蒸干并灼烧得到固体残留物 | 该固体为NaAlO2 |
| A. | A | B. | B | C. | C | D. | D |
8.人类生活、社会的可持续发展与化学密切相关,下列有关叙述正确的是( )
| A. | 高压钠灯能发出透雾能力强的淡紫色光,常用做路灯 | |
| B. | 用水清洗盛装过浓硫酸的铁捅要远离火源 | |
| C. | 理电池应用广泛,是因为锉能直接与水反应,不需要特殊的电解质溶液 | |
| D. | 据报导,一定条件下氢气可转变为金属氢,金属氢具备超导等优良性能.由氢气转变为金属氢属于同一元索的同位素之间的转化 |
 ,
, ,
,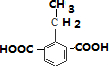 ,
, .
.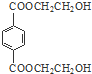 .
.