题目内容
3.已知下列两个气态物质之间的反应:C2H2(g)+H2(g)?C2H4(g) ①2CH4(g)?C2H4(g)+2H2(g) ②
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:(Q1、Q2、Q3均为正值)
C(s)+2H2(g)?CH4 (g)△H=-Q1Ⅰ
C(s)+H2(g)═C2H2(g)△H=-Q2Ⅱ
C(s)+H2(g)═$\frac{1}{2}$C2H4(g)△H=-Q3Ⅲ
Q值大小比较正确的是( )
| A. | Q1>Q3>Q2 | B. | Q1>Q2>Q3 | C. | Q2>Q1>Q3 | D. | Q3>Q1>Q2 |
分析 降低温度时①式平衡向右移动,②式平衡向左移动,则①为放热反应,②为吸热反应,
结合盖斯定律可知,Ⅲ-Ⅱ得到①,Ⅲ×2-Ⅰ×2得到②,以此来解答.
解答 解:降低温度时①式平衡向右移动,②式平衡向左移动,则①为放热反应,②为吸热反应,
结合盖斯定律可知,Ⅲ-Ⅱ得到①,则(-Q3)-(-Q2)<0,即Q3>Q2,
Ⅲ×2-Ⅰ×2得到②,得到2CH4(g)?C2H4(g)+2H2(g),△H=2(Q1-Q3),②中的反应为吸热反应,则2(Q1-Q3)>0,所以Q1>Q3;
综上所述,Q1>Q3>Q2,
故选A.
点评 本题考查反应热与焓变,为高频考点,把握盖斯定律的应用、反应中能量变化为解答的关键,侧重分析与应用能力的考查,注意反应之间的关系,题目难度不大.

练习册系列答案
相关题目
4.某温度下,在2L的密闭容器中,加入1mol X(g)和2mol Y(g)发生反应:X(g)+mY(g)?3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%.在此平衡体系中加入1mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变,下列叙述不正确的是( )
| A. | m=2 | |
| B. | 两次平衡的平衡常数相同 | |
| C. | X与Y平衡转化率之比为1:1 | |
| D. | 第二次平衡时,Z的浓度为0.4mol•L-1 |
5.下列化工生产不符合实际的是( )
| A. | 海水提溴时用到热空气将Br2吹出 | B. | 工业制HCl时氯气在氢气中燃烧 | ||
| C. | 硫酸工业中使用到热交换器 | D. | 石油通过分馏得到裂化汽油 |
11.下列物质属于高分子化合物的是( )
| A. | 乙酸 | B. | 乙烯 | C. | 乙醇 | D. | 聚乙烯 |
18.蓄电池是一种可以反复充电、放电的装置,有一种蓄电池在充电(电解池)和放电(原电池)时发生的反应是NiO2+Fe+2H2O$?_{充电}^{放电}$ Fe(OH)2+Ni(OH)2,用该蓄电池电解(阴、阳极均为惰性电极)M(NO3)x溶液时,若此蓄电池工作一段时间后消耗0.36g 水.电解M(NO3)x溶液时某一极质量增加m g,金属M的相对原子质量(用m、x表示)的计算式为( )
| A. | 20mx | B. | 20x/m | C. | 25mx | D. | 50m/x |
12.下列关于各图象的解释或得出结论正确的是( )
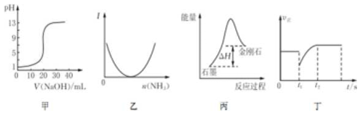

| A. | 图甲表示0.10mol•L-1NaOH溶液滴定20.00 mL 0.10 mol•L-1醋酸溶液的滴定曲线 | |
| B. | 图乙表示向乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 | |
| C. | 根据图丙所示可知:石墨转化为金刚石吸收热量,石墨比金刚石稳定 | |
| D. | 图丁表示反应2SO2+O2?2SO3,t1时刻只减小了 SO3的浓度 |
13.化学与生产、生活、社会发展等息息相关.下列说法正确的是( )
| A. | 为补充土壤中的钾元素,可在田间焚烧秸秆 | |
| B. | 煤经过气化、液化等物理变化可转变为清洁燃料 | |
| C. | 聚乙烯、聚氯乙烯均可作包装材料,且不会造成环境污染 | |
| D. | 在食品包装时放入盛有铁粉的透气小袋可防止食品氧化变质 |
 燃烧法是测定有机化合物化学式的一种重要方法.现完全燃烧一定质量的某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重3.6g,乙装置增重8.8g,又知该烃的蒸汽密度是同温同压下氢气密度的28倍.
燃烧法是测定有机化合物化学式的一种重要方法.现完全燃烧一定质量的某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重3.6g,乙装置增重8.8g,又知该烃的蒸汽密度是同温同压下氢气密度的28倍.