题目内容
19.我国目前大多数工厂以铬铁矿(主要成份为 FeO•Cr2O3,还含有A12O3、MgO等杂质)为主要原料生产二水合重铬酸钠(Na2Cr2O7•2H2O),其主要工艺流程如图所示. 步骤①中涉及的主要反应是:4FeO•Cr2O3+8Na2CO3+7O2═8Na2CrO4+2Fe2O3+8CO2.
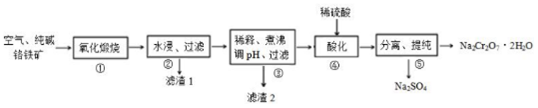
回答下列问题:
(1)二水合重铬酸钠(Na2Cr2O7•2H2O)中Cr的化合价为+3,氧化煅烧时将铬铁矿粉碎的目的是增大接触面积,加快铬铁矿煅烧速率.
(2)①中杂质 A12O3与纯碱反应转变为可溶性盐,写出 A12O3与纯碱反应的化学方程式Al2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2↑,滤渣1的主要成分为MgO和Fe2O3( 填化学式).
(3)滤渣2的成分是Al(OH)3( 填化学式).
(4)步骤④,向滤液中加入稀硫酸,溶液由黄色变为橙色,得到Na2Cr2O7和 Na2SO4的混合溶液,发生反应的离子方程式为2H++2CrO42-=2H2O+Cr2O72-.
(5)该工艺的酸性废液中含有Cr2O72-,向废液中加入绿矾(FeSO4•7H2O)还原处理,反应的离子方程式是Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O; 再向处理后的溶液中加入石灰水,使 c(Cr3+)降至10-5mol/L,此时溶液的pH值为5(已知:该条件下,Ksp=1.0×10-32).
分析 铬铁矿在空气中与纯碱煅烧生成Na2CrO4和一种红棕色固体,同时释放出CO2气体,同时A12O3+Na2CO3 $\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2↑,可知主反应为4Fe(CrO2)2+7O2+8Na2CO3$\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2,铬铁矿在空气中与纯碱煅烧生成物通过水浸NaAlO2进入浸出液中,而不溶的Fe2O3形成滤渣1,浸出液通过除杂,通入CO2气体,形成滤渣2Al(OH)3沉淀,最后分离出Na2CrO4溶液,经过酸化、过滤、结晶得到最终产品重铬酸钠晶体( Na2Cr2O7•2H2O);
(1)根据化合物中正负化合价之和为0计算Cr的化合价;从影响反应速率的因素角度考虑;
(2)根据流程图可知,煅烧过程中,铬铁矿中的Al2O3与纯碱反应生成了CO2,然后依据元素守恒配平,得化学方程式;煅烧时铬铁矿的成分之一Fe2O3没有参与反应,也不溶解与水中,
(3)铬铁矿煅烧时生成的NaAlO2在水溶液中与CO2生成Al(OH)3沉淀;
(4)步骤④,向滤液中加入稀硫酸,溶液由黄色变为橙色,得到Na2Cr2O7和 Na2SO4的混合溶液,说明溶液中存在CrO42-在酸性条件下转化为Cr2O72-的过程,是非氧化还原反应,只需要根据电荷守恒和原子守恒即可写出此反应的离子方程式;
(5)在酸性条件下,Fe2+可以将Cr2O72-还原为Cr3+,根据电子守恒、电荷守恒和原子守恒即可写出此反应的离子方程式;根据溶度积常数Ksp=c(Cr3+)×c3(OH-)=1.0×10-32,先计算出,再计算溶液pH.
解答 解:铬铁矿在空气中与纯碱煅烧生成Na2CrO4和一种红棕色固体,同时释放出CO2气体,同时A12O3+Na2CO3 $\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2↑,可知主反应为4Fe(CrO2)2+7O2+8Na2CO3$\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2,铬铁矿在空气中与纯碱煅烧生成物通过水浸NaAlO2进入浸出液中,而不溶的Fe2O3形成滤渣1,浸出液通过除杂,通入CO2气体,形成滤渣2Al(OH)3沉淀,最后分离出Na2CrO4溶液,经过酸化、过滤、结晶得到最终产品重铬酸钠晶体( Na2Cr2O7•2H2O);
(1)Fe(CrO2)2中,Fe为+2价,+2+2[x+(-2)×2]=0,解得x=+3;化煅烧时将铬铁矿粉碎,增大接触面积,加快铬铁矿煅烧速率,
故答案为:+3;增大接触面积,加快铬铁矿煅烧速率;
(2)根据流程图可知,煅烧过程中,铬铁矿中的Al2O3与纯碱反应生成了CO2,然后依据元素守恒配平,得化学方程式为Al2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2↑;煅烧时铬铁矿的成分之一Fe2O3没有参与反应,也不溶解与水中,所以滤渣1的成分为Fe2O3,
故答案为:Al2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2↑;Fe2O3;
(3)铬铁矿煅烧时生成的NaAlO2在水溶液中与CO2生成Al(OH)3沉淀,故滤渣2的成分为Al(OH)3,故答案为:Al(OH)3;
(4)已知2H++2CrO42-?2H2O+Cr2O72-向滤液中加入稀硫酸,溶液由黄色变为橙色,说明平衡正向移动,发生反应的离子方程式为2H++2CrO42-=2H2O+Cr2O72-,故答案为:2H++2CrO42-=2H2O+Cr2O72-;
(5)在酸性条件下,Fe2+可以还原Cr2O72-为Cr3+,发生反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;已知Ksp=c(Cr3+)×c3(OH-)=1.0×10-32、c(Cr3+)=10-5mol/L,则c(OH-)=1.0×10-9mol/L,则c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1×1{0}^{-14}}{{10}^{-9}}$mol/L=10-5mol/L,则溶液的pH=5,
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;5.
点评 作为工业流程题,本题思路比较清晰,涉及反应原理分析、实验的基本操作及溶液的pH计算,题项设置简单,综合程度较高,同时考查学生分析问题和解决问题能力,难度中等.

| A. | Na与Na2SO4在灼烧时火焰颜色相同 | |
| B. | 焰色反应实验中常用稀盐酸洗涤金属丝 | |
| C. | 可以用焰色反应来区别NaCl和KCl | |
| D. | 观察K2CO3的焰色应透过红色的玻璃 |
| A. | 盛放NaOH溶液的试剂瓶用磨口玻璃塞 | |
| B. | 氢氟酸保存在塑料瓶中 | |
| C. | 过氧化钠保存在广口瓶中 | |
| D. | 浓盐酸保存在细口试剂瓶中 |
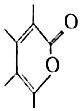 以下说法正确的是( )
以下说法正确的是( )| A. | 一Me基团的电子式为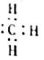 | |
| B. | 该合成过程的反应类型属于加成反应 | |
| C. | 产物与 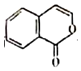 互为同分异构体 互为同分异构体 | |
| D. | 产物可与H2发生加成反应,反应的物质的量之比为1:3 |
| A. | m=2 | |
| B. | 两次平衡的平衡常数相同 | |
| C. | X与Y平衡转化率之比为1:1 | |
| D. | 第二次平衡时,Z的浓度为0.4mol•L-1 |
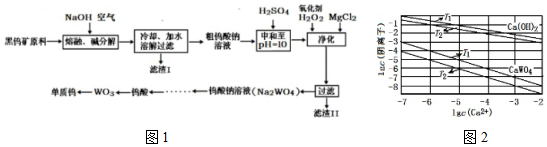
已知:①滤渣I的主要成份是Fe2O3、MnO2;
②上述流程中,除最后一步外,其余步骤中钨的化合价未变;
③常温下钨酸难溶于水.
回答下列问题:
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为+6,请写出MnWO4在熔融条件下发生碱分解反应生成MnO2的化学方程式2MnWO4+O2+4NaOH$\frac{\underline{\;高温\;}}{\;}$2MnO2+2Na2WO4+2H2O.
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子为SiO32-、HAsO32-、HAsO42-、HPO42-等,“净化”过程中,加入H2O2的目的是氧化HAsO32-生成HAsO42-,滤渣Ⅱ的主要成分是MgSiO3、MgHAsO4、MgHPO4 .
(3)高温下密闭容器中用H2还原WO3可得到金属钨,其反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表.
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
WO2(s)+2H2(g)?W(s)+2H2O(g)△H=+66.0KJ•mol-1
WO2(s)?WO2(g)△H=+203.9KJ•mol-1
则在700℃时,WO2(g)与H2(g)反应生成固体W(s)的热化学方程式为WO2(g)+2H2(g)?W(s)+2H2O(g△H=-137.9kJ•mol-1.
(4)已知氢氧化钙和钨酸钙(CaWO4)都是微溶性的电解质,两者的溶解度均随温度升高而减小.不同温度下两种物质的沉淀溶解平衡曲线如图2,则T1时Ksp(CaWO4)=1×10-10.在钨酸钠溶液中加入石灰乳得到大量钨酸钙,则T2时该反应的平衡常数为1×103.
(5)利用电解法可以从碳化钨(WC)废料中回收钨.电解时,用碳化钨做阳极,不锈钢做阴极,盐酸为电解液,阳极析出钨酸并放出CO2,该阳极反应式为WC+6H2O-10e-=H2WO4+CO2↑+10H+.
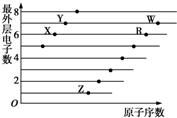 如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )
如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )| A. | X与W形成的化合物中只有共价键 | B. | X与Z形成的化合物中只有离子键 | ||
| C. | 元素的非金属性:X>R>W | D. | 简单离子的半径:W>R>X |