题目内容
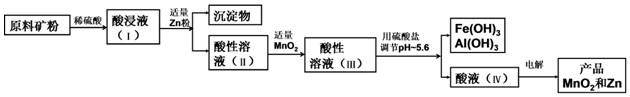
6.将6.5g锌投入200mL某浓度的稀盐酸中,锌和稀盐酸恰好完全反应.求:(1)所用稀盐酸中HCl的物质的量浓度;
(2)反应中生成的H2在标准状况下的体积;
(3)向反应后的溶液中加水至500mL,求此时氯化锌的物质的量浓度.
分析 发生Zn+2HCl=ZnCl2+H2↑,n(Zn)=$\frac{6.5g}{65g/mol}$=0.1mol,结合反应及c=$\frac{n}{V}$、V=nVm计算.
解答 解:(1)n(Zn)=$\frac{6.5g}{65g/mol}$=0.1mol,由反应可知,n(HCl)=0.1mol×2=0.2mol,稀盐酸中HCl的物质的量浓度为$\frac{0.2mol}{0.2L}$=1.0 mol/L,
答:稀盐酸中HCl的物质的量浓度为1.0mol/L;
(2)n(H2)=n(Zn)=0.1mol,则反应中生成的H2在标准状况下的体积为0.1mol×22.4L/mol=2.24 L,
答:反应中生成的H2在标准状况下的体积为2.24L;
(3)n(ZnCl2)=n(Zn)=0.1mol,加水至500mL,此时氯化锌的物质的量浓度为$\frac{0.1mol}{0.5L}$=0.2 mol/L,
答:氯化锌的物质的量浓度为0.2mol/L.
点评 本题考查化学反应的计算,为高频考点,把握发生的反应、物质的量关系为解答的关键,侧重分析与计算能力的考查,注意基本计算公式的应用,题目难度不大.

练习册系列答案
相关题目
8.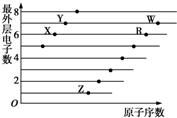 如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )
如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )
 如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )
如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )| A. | X与W形成的化合物中只有共价键 | B. | X与Z形成的化合物中只有离子键 | ||
| C. | 元素的非金属性:X>R>W | D. | 简单离子的半径:W>R>X |
5.下列化工生产不符合实际的是( )
| A. | 海水提溴时用到热空气将Br2吹出 | B. | 工业制HCl时氯气在氢气中燃烧 | ||
| C. | 硫酸工业中使用到热交换器 | D. | 石油通过分馏得到裂化汽油 |
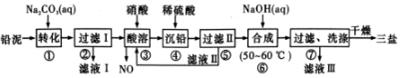
1.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表: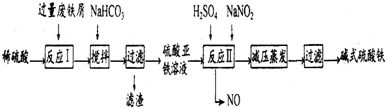
回答下列问题:
(1)反应I溶液中存在的金属阳离子有Fe2+、Al3+.
(2)加入NaHCO3的目的是调节pH,使溶液中的Al3+(填“Fe3+”、“Fe2+”或“A13+”)沉淀.该工艺流程中“搅拌”的作用是加快反应速率.
(3)反应II的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.在实际生产中,反应II常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作为氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2物质的量为2mol.
(4)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成${[{F{e_2}{{({OH})}_4}}]^{2+}}$聚合离子.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)反应I溶液中存在的金属阳离子有Fe2+、Al3+.
(2)加入NaHCO3的目的是调节pH,使溶液中的Al3+(填“Fe3+”、“Fe2+”或“A13+”)沉淀.该工艺流程中“搅拌”的作用是加快反应速率.
(3)反应II的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.在实际生产中,反应II常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作为氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2物质的量为2mol.
(4)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成${[{F{e_2}{{({OH})}_4}}]^{2+}}$聚合离子.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
11.下列物质属于高分子化合物的是( )
| A. | 乙酸 | B. | 乙烯 | C. | 乙醇 | D. | 聚乙烯 |