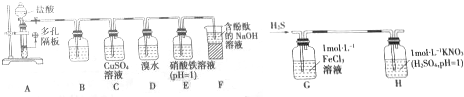
题目内容
2.某同学在配制一定物质的量浓度的NaCl溶液时,有下列不当操作:①称量时天平未达平衡(左高右低)
②定容时,眼睛俯视刻度线
这两处不当操作对所得溶液浓度的影响是( )
| A. | 都导致浓度偏大 | B. | ①导致浓度偏小,②导致浓度偏大 | ||
| C. | 都导致浓度偏小 | D. | ①导致浓度偏大,②导致浓度偏小 |
分析 ①称量时天平未达平衡(左高右低),说明称量的氢氧化钠的物质的量偏小;
②定容时,眼睛俯视刻度线,加入的蒸馏水体积偏小,配制的溶液体积偏小,根据操作方法对c=$\frac{n}{V}$的影响进行分析产生的误差.
解答 解:①称量时天平未达平衡(左高右低),说明砝码的质量偏大,则称量的NaOH的质量偏小,配制的溶液中含有氢氧化钠的物质的量偏小,则所得溶液浓度偏低;
②定容时,眼睛俯视刻度线,导致加入的蒸馏水体积偏小,配制的溶液体积偏小,根据c=$\frac{n}{V}$可知配制的溶液浓度偏高;
根据分析可知:①导致浓度偏小,②导致浓度偏大,
故选B.
点评 本题考查了配制一定物质的量浓度的溶液中的误差分析,题目难度不大,明确正确的操作方法为解答关键,注意根据操作方法对c=$\frac{n}{V}$的影响分析误差,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
10.要把100mL•12mol•L-1盐酸(密度为1.19g•cm-3)稀释成6mol•L-1盐酸(密度为1.10g•cm-3),需要加水的体积约为( )
| A. | 100mL | B. | 101mL | C. | 119mL | D. | 120mL |
10.等质量的下列有机物完全燃烧时,耗氧量最大的是( )
| A. | 甲烷 | B. | 乙烯 | C. | 丙烷 | D. | 苯 |
14.水溶液X中只可能含有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子.某同学对该溶液X进行了如下实验:下列判断正确的是( )
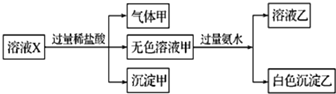

| A. | 气体甲一定是纯净物 | |
| B. | 沉淀甲是硅酸和硅酸镁的混合物 | |
| C. | K+、AlO2-和SiO32-一定存在于溶液X中 | |
| D. | 仅凭以上实验不能确定SO42-是否存在于溶液X中 |
11.现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:
为鉴别它们,分别完成以下实验,其结果是:
a.B和D都不溶于水,也不溶于酸;
b.A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀;
c.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀;
d.E溶于水后,与上述某阴离子反应可生成B;
e.A溶液与适量E溶液反应生成沉淀,再加入过量E溶液,沉淀量减少,但不消失.
请根据上述实验结果,填空:
(1)写出化合物的化学式:BBaSO4、CAlCl3、DAgCl
(2)写出下列离子方程式
①A溶液与少量的E溶液反应:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓;
②A溶液与过量的E溶液反应:2Al3++3SO42-+3Ba2++8OH-=3BaSO4↓+2AlO2-+4H2O.
| 阳离子 | Ag+ Ba2+ A13+ |
| 阴离子 | OH- C1- SO42- |
a.B和D都不溶于水,也不溶于酸;
b.A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀;
c.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀;
d.E溶于水后,与上述某阴离子反应可生成B;
e.A溶液与适量E溶液反应生成沉淀,再加入过量E溶液,沉淀量减少,但不消失.
请根据上述实验结果,填空:
(1)写出化合物的化学式:BBaSO4、CAlCl3、DAgCl
(2)写出下列离子方程式
①A溶液与少量的E溶液反应:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓;
②A溶液与过量的E溶液反应:2Al3++3SO42-+3Ba2++8OH-=3BaSO4↓+2AlO2-+4H2O.
12.下列各物质中互为同系物的是( )
| A. | 苯、溴苯 | B. | 正丁烷和异丁烷 | C. | 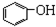 和 和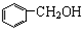 | D. | 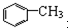 和 和 |
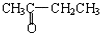 B.
B.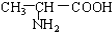 与
与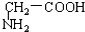
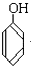 与
与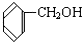 D.CH3CH2C≡CH与CH2═CH-CH═CH2E.
D.CH3CH2C≡CH与CH2═CH-CH═CH2E.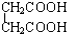 与
与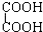 F.戊烯和环丙烯
F.戊烯和环丙烯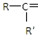 氧化成(R、R′
氧化成(R、R′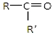 可表示烃基或官能团),若将A中两化合物看作是某单烯烃被臭氧氧化生成的,则该单烯烃的结构简式为CH3CH2CH2CH=C(CH3)CH2CH3.
可表示烃基或官能团),若将A中两化合物看作是某单烯烃被臭氧氧化生成的,则该单烯烃的结构简式为CH3CH2CH2CH=C(CH3)CH2CH3.