题目内容
10.等质量的下列有机物完全燃烧时,耗氧量最大的是( )| A. | 甲烷 | B. | 乙烯 | C. | 丙烷 | D. | 苯 |
分析 相同质量的各烃完全燃烧,耗氧量取决于H元素的质量分数,分子中H元素的质量分数越高,耗氧量越大,计算分子中C原子与H原子数目之比,相同C原子,H原子数目越大,H元素质量分数越大,耗氧量越大,据此进行解答.
解答 解:A.甲烷的分子式为CH4,其分子中N(C):N(H)=1:4;
B.乙烯的分子式为C2H4,其分子中N(C):N(H)=2:4=1:2;
C.丙烷的分子式为C3H8,其分子中N(C):N(H)=3:8=1:$\frac{8}{3}$;
D.苯的分子式为C6H6,其分子中N(C):N(H)=6:6=1:1;
等质量的烃燃烧,耗氧量取决于氢元素的含量,含氢量越大耗氧量越大,显然CH4中H的质量分数最大,相同质量时CH4的耗氧量最大,
故选A.
点评 本题考查有机物燃烧反应的计算,为高频考点,把握相同质量的C、H消耗氧气的质量确定H的质量分数越大、耗氧量越大为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案
相关题目
17.下列物质性质与应用对应关系正确的是( )
| A. | 氧化铝熔点高,可用于制作耐火材料 | |
| B. | 氢氧化铝难溶于水,可用于制胃酸中和剂 | |
| C. | Na2O2具有强氧化性,可用作自来水的消毒剂 | |
| D. | 氧化铁能与酸反应,可用于制作红色涂料 |
18.下列说法正确的是( )
| A. | 糖类在一定条件下可以水解生成乙醇和二氧化碳 | |
| B. | 检验淀粉在稀硫酸催化条件下水解产物的方法:取适量水解液于试管中,加入少量新制Cu(OH)2溶液,加热,观察是否出现砖红色沉淀 | |
| C. | 煤制煤气是物理变化,是高效、清洁地利用煤的重要途径 | |
| D. | 蛋白质在紫外线、CuSO4溶液、福尔马林作用下均会发生变性 |
5.X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.H与G同主族,且比G多2个电子层.请回答下列问题:
(1)Y在元素周期表中的位置为第二周期第ⅥA族.
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),M、G的非金属气态氢化物还原性更强的是H2S(写化学式).
(3)用电子式表示XG的形成过程 .
.
(4)ZX的电子式为Na+[:H]-;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
(5)X、Y两元素所形成化合物的电子式为 、
、 .
.
(6)比较G的单质与H的单质的氧化性的强弱:Cl2>I2(写化学式),请设计实验加以证明
(所用试剂自选)
(1)Y在元素周期表中的位置为第二周期第ⅥA族.
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),M、G的非金属气态氢化物还原性更强的是H2S(写化学式).
(3)用电子式表示XG的形成过程
 .
.(4)ZX的电子式为Na+[:H]-;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
(5)X、Y两元素所形成化合物的电子式为
 、
、 .
.(6)比较G的单质与H的单质的氧化性的强弱:Cl2>I2(写化学式),请设计实验加以证明
(所用试剂自选)
| 实验操作 | 实验现象 |
| 取KI溶液于试管中,向其中加入少量或适量氯水 向上述溶液中加入CCl4(或加滴淀粉)振荡、静置 (或淀粉-KI溶液或淀粉-KI试纸→必须润湿) 或在淀粉-KI试纸上滴加氯水 | 分层,上层几乎无色,下层紫红色 (试纸变蓝) |
15.将一定质量Mg、Zn、Al的混合物与足量稀硫酸反应,生成H25.6L(标准状况),则原混合物的质量可能是( )
| A. | 2g | B. | 4g | C. | 8g | D. | 18g |
2.某同学在配制一定物质的量浓度的NaCl溶液时,有下列不当操作:
①称量时天平未达平衡(左高右低)
②定容时,眼睛俯视刻度线
这两处不当操作对所得溶液浓度的影响是( )
①称量时天平未达平衡(左高右低)
②定容时,眼睛俯视刻度线
这两处不当操作对所得溶液浓度的影响是( )
| A. | 都导致浓度偏大 | B. | ①导致浓度偏小,②导致浓度偏大 | ||
| C. | 都导致浓度偏小 | D. | ①导致浓度偏大,②导致浓度偏小 |
19.位于前四周期的6种主族元素A、B、C、D、E、F原子序数依次增大,其中B、D同主族,D、E同周期.A、B、C在周期表中相邻,且三种元素的原子最外层电子数之和为18.F是其所在周期中最活泼的金属元素.根据推断回答下列问题:
(1)A在周期表中的位置第二周期、ⅤA族:写出D与F形成的最简单离子化合物的电子式K+ K+.
K+.
(2)用“>”或“<”填空:
(3)一定条件,在水溶液中1mol E-、EBx-(x=1,2,3,4)的能量(KJ)相对大小如图所示.
①d点对应的微粒是ClO4-(填离子符号)
②b→a+c反应的离子方程式为3ClO-=ClO3-+2Cl-,该反应是放热反应(填“吸热”或“放热”)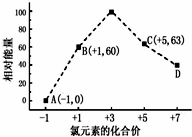
(1)A在周期表中的位置第二周期、ⅤA族:写出D与F形成的最简单离子化合物的电子式K+
 K+.
K+.(2)用“>”或“<”填空:
| 离子半径 | 非金属性 | 酸性 | 沸点 |
| F+<D2- | A<B | D的最高价氧化物的水化物<E的最高价氧化物的水化物 | C的氢化物>E的氢化物 |
①d点对应的微粒是ClO4-(填离子符号)
②b→a+c反应的离子方程式为3ClO-=ClO3-+2Cl-,该反应是放热反应(填“吸热”或“放热”)

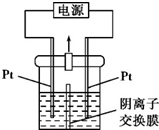 某实验小组的同学用图所示的实验装置进行电解反应,电解槽内装有KI-淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.
某实验小组的同学用图所示的实验装置进行电解反应,电解槽内装有KI-淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.