题目内容
14.水溶液X中只可能含有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子.某同学对该溶液X进行了如下实验:下列判断正确的是( )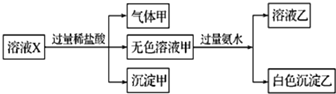
| A. | 气体甲一定是纯净物 | |
| B. | 沉淀甲是硅酸和硅酸镁的混合物 | |
| C. | K+、AlO2-和SiO32-一定存在于溶液X中 | |
| D. | 仅凭以上实验不能确定SO42-是否存在于溶液X中 |
分析 溶液X中进入过量盐酸,生成的气体甲,气体甲可能为二氧化硫或者二氧化碳,原溶液中可能存在SO32-、CO32-,溶液中一定不存在Mg2+、Al3+,再根据溶液电中性可知,原溶液中一定存在唯一的阳离子K+;
加入盐酸生成了沉淀甲,根据题干的离子可知,溶液中一定存在SiO32-,沉淀甲为硅酸;
无色溶液甲中加入过量氨水,得到的白色沉淀,说明原溶液中一定存在AlO2-,白色沉淀乙为氢氧化铝,
根据以上分析进行判断.
解答 解:溶液X中进入过量盐酸,生成的气体甲可能为二氧化硫或者二氧化硫,原溶液中可能存在SO32-、CO32-,根据离子共存可知,原溶液中一定不存在Mg2+、Al3+,结合溶液电中性可知,原溶液中一定存在K+;
由于加入盐酸生成了沉淀甲,根据题干中的离子可知,远溶液中一定存在SiO32-,沉淀甲为硅酸;
无色溶液甲中加入过量氨水,得到的白色沉淀,说明原溶液中一定存在AlO2-,白色沉淀乙为氢氧化铝,
A.由于加入的盐酸过量,生成的沉淀甲为硅酸,不会含有硅酸镁,故A错误;
B.根据以上分析可知,气体甲可能为二氧化碳和二氧化硫的混合物,故B错误;
C.根据以上分析可知,原溶液中一定存在K+、AlO2-和SiO32-,故C正确;
D.根据分析可知,不能确定SO42-是否存在于溶液X中,故D正确;
故选CD.
点评 本题考查常见离子的检验方法,题目难度中等,注意掌握常见离子的性质及检验方法,要求学生能够根据反应现象判断离子存在情况,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
1.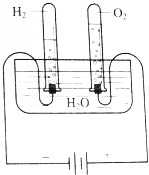 (1)根据图所示的电解水原理进行实验,观察不同时间试管内的气体体积的变化.生成的O2和H2体积的比各约为多少?
(1)根据图所示的电解水原理进行实验,观察不同时间试管内的气体体积的变化.生成的O2和H2体积的比各约为多少?
(2)假设电解了1.8g H2O,根据电解水的化学方程式计算生成O2、H2的质量,根据O2、H2的摩尔质量,计算物质的量,并通过下表进行比较.
根据该实验的观察与推算能否初步得出下列结论:在相同温度和压强下.1molO2和H2的体积相同.
 (1)根据图所示的电解水原理进行实验,观察不同时间试管内的气体体积的变化.生成的O2和H2体积的比各约为多少?
(1)根据图所示的电解水原理进行实验,观察不同时间试管内的气体体积的变化.生成的O2和H2体积的比各约为多少?(2)假设电解了1.8g H2O,根据电解水的化学方程式计算生成O2、H2的质量,根据O2、H2的摩尔质量,计算物质的量,并通过下表进行比较.
| 质量g | 物质的量 | H2 和O2物质的量的比 | |
| H2 | |||
| O2 |
5.X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.H与G同主族,且比G多2个电子层.请回答下列问题:
(1)Y在元素周期表中的位置为第二周期第ⅥA族.
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),M、G的非金属气态氢化物还原性更强的是H2S(写化学式).
(3)用电子式表示XG的形成过程 .
.
(4)ZX的电子式为Na+[:H]-;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
(5)X、Y两元素所形成化合物的电子式为 、
、 .
.
(6)比较G的单质与H的单质的氧化性的强弱:Cl2>I2(写化学式),请设计实验加以证明
(所用试剂自选)
(1)Y在元素周期表中的位置为第二周期第ⅥA族.
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),M、G的非金属气态氢化物还原性更强的是H2S(写化学式).
(3)用电子式表示XG的形成过程
 .
.(4)ZX的电子式为Na+[:H]-;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
(5)X、Y两元素所形成化合物的电子式为
 、
、 .
.(6)比较G的单质与H的单质的氧化性的强弱:Cl2>I2(写化学式),请设计实验加以证明
(所用试剂自选)
| 实验操作 | 实验现象 |
| 取KI溶液于试管中,向其中加入少量或适量氯水 向上述溶液中加入CCl4(或加滴淀粉)振荡、静置 (或淀粉-KI溶液或淀粉-KI试纸→必须润湿) 或在淀粉-KI试纸上滴加氯水 | 分层,上层几乎无色,下层紫红色 (试纸变蓝) |
2.某同学在配制一定物质的量浓度的NaCl溶液时,有下列不当操作:
①称量时天平未达平衡(左高右低)
②定容时,眼睛俯视刻度线
这两处不当操作对所得溶液浓度的影响是( )
①称量时天平未达平衡(左高右低)
②定容时,眼睛俯视刻度线
这两处不当操作对所得溶液浓度的影响是( )
| A. | 都导致浓度偏大 | B. | ①导致浓度偏小,②导致浓度偏大 | ||
| C. | 都导致浓度偏小 | D. | ①导致浓度偏大,②导致浓度偏小 |
9.Y元素的阳离子和X元素的阴离子具有与氩原子相同的电子层结构,下列叙述不正确的是( )
| A. | Y的原子序数比X的大 | B. | Y的原子半径比X的大 | ||
| C. | Y原子的最外层电子数比X的大 | D. | Y元素的最高正价比X的大 |
19.位于前四周期的6种主族元素A、B、C、D、E、F原子序数依次增大,其中B、D同主族,D、E同周期.A、B、C在周期表中相邻,且三种元素的原子最外层电子数之和为18.F是其所在周期中最活泼的金属元素.根据推断回答下列问题:
(1)A在周期表中的位置第二周期、ⅤA族:写出D与F形成的最简单离子化合物的电子式K+ K+.
K+.
(2)用“>”或“<”填空:
(3)一定条件,在水溶液中1mol E-、EBx-(x=1,2,3,4)的能量(KJ)相对大小如图所示.
①d点对应的微粒是ClO4-(填离子符号)
②b→a+c反应的离子方程式为3ClO-=ClO3-+2Cl-,该反应是放热反应(填“吸热”或“放热”)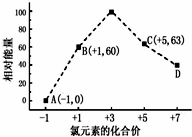
(1)A在周期表中的位置第二周期、ⅤA族:写出D与F形成的最简单离子化合物的电子式K+
 K+.
K+.(2)用“>”或“<”填空:
| 离子半径 | 非金属性 | 酸性 | 沸点 |
| F+<D2- | A<B | D的最高价氧化物的水化物<E的最高价氧化物的水化物 | C的氢化物>E的氢化物 |
①d点对应的微粒是ClO4-(填离子符号)
②b→a+c反应的离子方程式为3ClO-=ClO3-+2Cl-,该反应是放热反应(填“吸热”或“放热”)

4.“市民利益无小事,食品安全是大事”,袋装食品更受各部门的关注,为了延长食品的保质期,在袋装食品的袋中往往放入一小包上面标有“不可食用”的字,则这包中装的物质可能是( )
| A. | 食盐和味精 | B. | 味精和糖 | C. | 铁粉和硅胶 | D. | 铁粉和碱石灰 |

 .
. 等.
等.
 为原料制备化合物X(结构简式见图
为原料制备化合物X(结构简式见图 )
)