题目内容
17.在25℃、1.01×105Pa下,将33gCO2通入到1000ml1.0mol•L-1的NaOH溶液中充分反应,放出xkJ热量.在该条件下1molCO2通入到2L1.0mol•L-1的NaOH溶液中充分反应,放出ykJ热量,则CO2与NaOH反应生成NaHCO3的热化学反应方程式为( )| A. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(4x-y)kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-1/2(4x-y)kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(8x-2y)kJ•mol-1 |
分析 根据题意可知,将33gCO2通入到1000ml1.0mol•L-1的NaOH溶液中充分反应,测得反应放出xkJ的热量,写出热化学反应方程式,再利用1molCO2通入到2L1.0mol•L-1的NaOH溶液中充分反应,放出ykJ热量写出热化学反应方程式,最后利用盖斯定律来书写CO2与NaOH溶液反应生成NaHCO3的热化学方程式.
解答 解:根据题意,33gCO2通入1mol•L-1NaOH溶液1000mL中充分反应,n(CO2)=$\frac{33g}{44g/mol}$=0.75mol,n(NaOH)=1mol•L-1×1L=1mol,
该反应既生成碳酸钠又生成碳酸氢钠,该反应的方程式为:3CO2+4NaOH═2NaHCO3+Na2CO3+H2O,
由0.75molCO2反应放出热量为xKJ,则3molCO2反应放出热量为4xkJ,即热化学反应方程式为
3CO2(g)+4NaOH(aq)═2NaHCO3 (aq)+Na2CO3(aq)+H2O(l)△H=-4xkJ/mol①,
1molCO2通入到2L1.0mol•L-1的NaOH溶液中充分反应,放出ykJ热量,则热化学方程式为
2NaOH(aq)+CO2(g)═Na2CO3(aq)+H2O(l)△H=-yKJ/mol②,
由盖斯定律$\frac{1}{2}$(①-②)可得:CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-$\frac{1}{2}$(4x-y)kJ•mol-1,
故选C.
点评 本题考查反应热与焓变的应用,题目难度中等,正确书写热化学方程式为解答关键,注意掌握盖斯定律的内容及应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
7.活性氧化锌用作橡胶硫化的活性剂、补强剂.以氧化锌粗品为原料制备活性氧化锌的生产工艺流程如图:
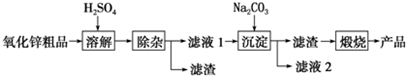
一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表
(1)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是增大固液接触面积,加快溶解时的反应速率.
(2)溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质.先加入Na2CO3(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4 转化为MnO2.经检测溶液中Fe2+的浓度为0.009mol•L-1,则每升溶液中至少应加入0.003mol KMnO4.
(3)杂质Cu2+可利用置换反应除去,应选择的试剂是锌粉.
(4)“沉淀”得到ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,“煅烧”反应的化学方程式为:ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃~500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
(5)已知氢氧化锌能容于氨水,锌离子能与NH3分子形成四个配位键的配离子.请写出氢氧化锌和NH3分子反应的离子方程式Zn(OH)2+4NH3=Zn(NH3)42++2OH-.
(6)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是①④(填序号)
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和碳酸钠 ④硫酸锌和氨水.

一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
(2)溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质.先加入Na2CO3(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4 转化为MnO2.经检测溶液中Fe2+的浓度为0.009mol•L-1,则每升溶液中至少应加入0.003mol KMnO4.
(3)杂质Cu2+可利用置换反应除去,应选择的试剂是锌粉.
(4)“沉淀”得到ZnCO3•2Zn(OH)2•H2O,“煅烧”在450~500℃下进行,“煅烧”反应的化学方程式为:ZnCO3•2Zn(OH)2•H2O$\frac{\underline{\;450℃~500℃\;}}{\;}$3ZnO+CO2↑+3H2O↑.
(5)已知氢氧化锌能容于氨水,锌离子能与NH3分子形成四个配位键的配离子.请写出氢氧化锌和NH3分子反应的离子方程式Zn(OH)2+4NH3=Zn(NH3)42++2OH-.
(6)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是①④(填序号)
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和碳酸钠 ④硫酸锌和氨水.
8.关于胶体,下列说法正确的是( )
| A. | 胶体的聚沉是化学变化 | |
| B. | 含有0.01mol FeCl3的溶液制成的胶体中,胶体粒子的数目约为6.02×1021个 | |
| C. | 胶体的介稳性与胶体粒子直径大小有关 | |
| D. | NaCl晶体既可制成溶液又可制成胶体 |
12.T℃时在1L密闭容器中A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图2所示.则下列结论正确的是( )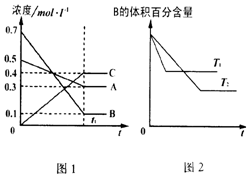

| A. | 在达平衡后,保持其他条件不变,增大压强,平衡向正反应方向移动 | |
| B. | 保持其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 | |
| C. | T℃时,若由0.4mol•L -1A、0.4mol•L -1B、0.2mol•L -1C反应,达到平衡后,C的浓度为0.8mol•L -1 | |
| D. | 在达平衡后,保持压强不变,通入稀有气体,平衡向正反应方向移动 |
2.以下命题符合化学变化规律的是( )
| A. | 金属铜制成纳米铜 | B. | 把水变成汽油 | ||
| C. | 热核聚变把氢原子变成氦原子 | D. | 干冰变成原子晶体 |
7. 向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/LBa(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所所得沉淀的量的关系如图,下列说法不正确的是( )
向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/LBa(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所所得沉淀的量的关系如图,下列说法不正确的是( )
 向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/LBa(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所所得沉淀的量的关系如图,下列说法不正确的是( )
向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/LBa(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所所得沉淀的量的关系如图,下列说法不正确的是( )| A. | 图中C点铝元素存在的形式是AlO2- | |
| B. | 原混合溶液中c[Al2(SO4)3]:c(AlCl3)=1:2 | |
| C. | 向D点溶液中通入过量CO2气体,最终将得到9mol沉淀 | |
| D. | OA段反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4 |
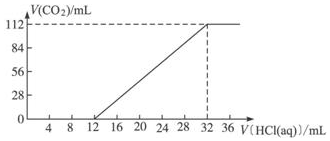 ⅠA族金属元素(R)组成的两种碳酸盐R2CO3与RHCO3的混合物6.14g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的体积(已折算成标准状况下的体积)和消耗稀盐酸的体积,得到如图所示的曲线.
ⅠA族金属元素(R)组成的两种碳酸盐R2CO3与RHCO3的混合物6.14g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的体积(已折算成标准状况下的体积)和消耗稀盐酸的体积,得到如图所示的曲线.