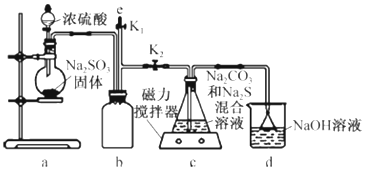
题目内容
8.关于胶体,下列说法正确的是( )| A. | 胶体的聚沉是化学变化 | |
| B. | 含有0.01mol FeCl3的溶液制成的胶体中,胶体粒子的数目约为6.02×1021个 | |
| C. | 胶体的介稳性与胶体粒子直径大小有关 | |
| D. | NaCl晶体既可制成溶液又可制成胶体 |
分析 A.有新物质生成的变化为化学变化;
B.胶体粒子是氢氧化铁的集合体;
C.胶体具有介稳定性主要是胶粒带有电荷;
D.氯化钠分散在酒精中形成胶体.
解答 解:A胶体的聚沉为分散质粒子的直径变大的过程.没有新物质生成是物理变化,故A错误;
B.含有0.01mol FeCl3的溶液制成的胶体中,胶体粒子的数目小于6.02×1021个,故B错误;
C.胶体具有介稳定性主要是同种胶体微粒带相同电荷,故C错误;
D.NaCl分散在水中形成溶液,分散在酒精中形成胶体,故D正确;
故选D.
点评 本题考查胶体的性质,明确胶体的聚沉、介稳性是解题关键,注意胶体微粒为集合体,题目难度不大.

练习册系列答案
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
12.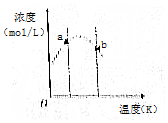 对反应3A(g)+xB(g)?2C(g),将3 molA和2 mol B气体通入体积固定为2L的密闭容器中,测得A与B的转化率相等,C的浓度与温度关系如图所示.下列说法正确的是( )
对反应3A(g)+xB(g)?2C(g),将3 molA和2 mol B气体通入体积固定为2L的密闭容器中,测得A与B的转化率相等,C的浓度与温度关系如图所示.下列说法正确的是( )
 对反应3A(g)+xB(g)?2C(g),将3 molA和2 mol B气体通入体积固定为2L的密闭容器中,测得A与B的转化率相等,C的浓度与温度关系如图所示.下列说法正确的是( )
对反应3A(g)+xB(g)?2C(g),将3 molA和2 mol B气体通入体积固定为2L的密闭容器中,测得A与B的转化率相等,C的浓度与温度关系如图所示.下列说法正确的是( )| A. | 该反应的正反应是吸热反应 | B. | a处反应速率比b处反应速率大 | ||
| C. | 反应方程式中计量数x=1 | D. | b状态时:v(正)=v(逆) |
16.反应2C+O2═2CO的能量变化如图所示.下列说法正确的是( )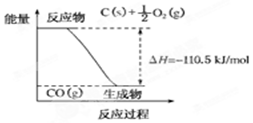

| A. | 12g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ | |
| B. | 2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ | |
| C. | 该反应的热化学方程式是2C(s)+O2(g)═2CO(g);△H=-221 kJ | |
| D. | 该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差 |
3.若用E表示某原子中各轨道的能量,下列轨道能量大小顺序正确的是( )
| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(1s) | C. | E(4f)>E(4s)>E(3d) | D. | E(5s)>E(4s)>E(4f) |
13.常温时,下列叙述正确的是( )
| A. | 稀释pH=3的醋酸,溶液中所有离子的浓度均降低 | |
| B. | 用标准盐酸滴定未知浓度的烧碱,滴定前仰视,滴定后俯视,烧碱浓度偏低 | |
| C. | pH均为11的NaOH和NH3•H2O溶液中,水的电离程度不相同 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
20.有一包铁粉和铜粉混合均匀的粉末样品,为确定其组成,某同学将不同质量的该样品分别与40mL 1mol•L-1的FeCl3溶液反应,实验结果如表所示(忽略反应前后溶液体积的微小变化).
计算:
(1)样品中铁和铜的物质的量之比n(Fe):n(Cu)=1:1.
(2)实验②的滤液中c(Fe2+)=1.375mol•L-1.
| 实验序号 | ① | ② | ③ | ④ |
| m(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| m(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
(1)样品中铁和铜的物质的量之比n(Fe):n(Cu)=1:1.
(2)实验②的滤液中c(Fe2+)=1.375mol•L-1.
17.在25℃、1.01×105Pa下,将33gCO2通入到1000ml1.0mol•L-1的NaOH溶液中充分反应,放出xkJ热量.在该条件下1molCO2通入到2L1.0mol•L-1的NaOH溶液中充分反应,放出ykJ热量,则CO2与NaOH反应生成NaHCO3的热化学反应方程式为( )
| A. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(4x-y)kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-1/2(4x-y)kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(8x-2y)kJ•mol-1 |
18.为了寻找半导体材料,应当( )
| A. | 在周期表金属与非金属区分界线附近找 | |
| B. | 在周期表左下方找 | |
| C. | 在周期表右上方找 | |
| D. | 在过渡元素中找 |