题目内容
12.T℃时在1L密闭容器中A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图2所示.则下列结论正确的是( )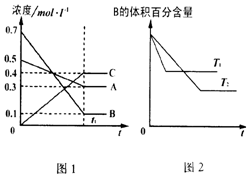
| A. | 在达平衡后,保持其他条件不变,增大压强,平衡向正反应方向移动 | |
| B. | 保持其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 | |
| C. | T℃时,若由0.4mol•L -1A、0.4mol•L -1B、0.2mol•L -1C反应,达到平衡后,C的浓度为0.8mol•L -1 | |
| D. | 在达平衡后,保持压强不变,通入稀有气体,平衡向正反应方向移动 |
分析 该反应达到平衡状态时,A浓度的变化量=(0.5-0.3)mol/L=0.2mol/L,B浓度的变化量=(0.7-0.1)mol/L=0.6mol/L,C浓度的变化量=(0.4-0)mol/L=0.4mol/L,同一化学反应同一时间段内,各物质浓度的变化量之比等于其计量数之比,所以该反应方程式为:A(g)+3B(g)?2C(g),
根据“先拐先平数值大”结合图II知,T1>T2,升高温度,B的体积发生增大,则该反应的正反应是放热反应;
A.增大压强,平衡向气体体积减小的方向移动;
B.根据“先拐先平数值大”结合图Ⅱ知,T1>T2,升高温度,平衡向吸热反应方向移动;
C.先根据图Ⅰ计算平衡常数,再根据平衡常数计算改变三种物质的浓度达到平衡状态时C的浓度;
D.在达平衡后,保持压强不变,通入稀有气体,容器体积变大,反应物所占分压减小,平衡向体积增大的方向移动.
解答 解:反应达到平衡状态时,A浓度的变化量=(0.5-0.3)mol/L=0.2mol/L,B浓度的变化量=(0.7-0.1)mol/L=0.6mol/L,C浓度的变化量=(0.4-0)mol/L=0.4mol/L,同一化学反应同一时间段内,各物质浓度的变化量之比等于其计量数之比,所以该反应方程式为:A(g)+3B(g)?2C(g),
根据“先拐先平数值大”结合图Ⅱ知,T1>T2,升高温度,B的体积发生增大,则该反应的正反应是放热反应;
A.该反应的正反应是气体体积减小的反应,t2时,保持其它条件和物质状态不变,增加压强,化学平衡向正反应方向移动,故A正确;
B.其它条件不变,升高温度,正逆反应速率都增大,平衡向吸热反应方向移动,根据图Ⅱ知,正反应是放热反应,所以平衡向逆反应方向移动,A的转化率降低,故B错误;
C.根据图Ⅰ知,化学平衡常数K=$\frac{0.{4}^{2}}{0.3×0.{1}^{3}}$=$\frac{1600}{3}$,
假设C的平衡浓度是0.8mol/L,
A(g)+3B(g)?2C(g)
开始(mol/L)0.4 0.4 0.2
反应(mol/L)0.3 0.9 0.6
平衡(mol/L) 0.7 0.1 0.8
B的浓度不足,故C错误;
D.在达平衡后,保持压强不变,通入稀有气体,容器体积变大,反应物所占分压减小,平衡向体积增大的方向移动,平衡逆向进行,故D错误;
故选A.
点评 本题考查外界条件对化学平衡移动的影响,正确确定反应方程式是解本题关键,会根据“先拐先平数值大”确定该反应是吸热反应还是放热反应,难度中等.

 草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取和草酸的性质,进行如下实验.
草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取和草酸的性质,进行如下实验.实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如图所示
①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸(65%的HNO3与98%的H2SO4的质量比2:1.25)
③反应3小时,冷却,抽滤后再重结晶得到草酸晶体,硝酸氧化淀粉水解液的反应为:C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
(1)如图实验装置中仪器乙的名称为:冷凝管.装置B的作用是防C中液体倒吸进A中(安全瓶).
(2)检验淀粉是否水解完全的方法:取样,加碘水,看是否变蓝,变蓝则证明水解不完全,否则,水解完全.
实验Ⅱ:探究草酸与酸性高锰酸钾的反应
(3)向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,写出上述反应的离子方程式:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(4)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快.为探究其原因,同学们做了如下对比实验;
| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(S) (g) | 褪色时间(S) | ||
| C(mol•L-1) | V(mL) | C(mol•L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
(5)草酸亚铁在工业中有重要作用,草酸可以制备草酸亚铁,步骤如下:
称取FeSO4•7H2O 固体于小烧杯中,加入水和少量稀H2SO4溶液酸化,加热溶解.向此溶液中加入一定量的H2C2O4溶液,将混合溶液加热至沸,不断搅拌,以免暴沸,待有黄色沉淀析出并沉淀后,静置.倾出上清液,再加入少量水,并加热,过滤,充分洗涤沉淀,过滤,用丙酮洗涤固体两次并晾干.
①生成的草酸亚铁需充分洗涤沉淀,检验是否洗涤完全的方法是取最后一次洗涤液1~2mL置于试管中,向其中滴加盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净.
②用丙酮洗涤固体两次的目的是降低草酸亚铁的溶解量,同时更快洗去表面的水分.
| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(1s) | C. | E(4f)>E(4s)>E(3d) | D. | E(5s)>E(4s)>E(4f) |
| 实验序号 | ① | ② | ③ | ④ |
| m(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| m(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
(1)样品中铁和铜的物质的量之比n(Fe):n(Cu)=1:1.
(2)实验②的滤液中c(Fe2+)=1.375mol•L-1.
| A. | H2C=CH-CH=CH2 1,3-二丁烯 | B. |  :间二甲苯 :间二甲苯 | ||
| C. | 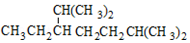 2,6-二甲基-5-乙基庚烷 2,6-二甲基-5-乙基庚烷 | D. | 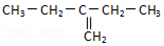 2-乙基-1-丁烯 2-乙基-1-丁烯 |
| A. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(4x-y)kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-1/2(4x-y)kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(8x-2y)kJ•mol-1 |
| A. | 丙烯和氯气光照--取代 | |
| B. | 乙烯和溴水的反应--氧化 | |
| C. | 乙烯使酸性高锰酸钾溶液褪色--加成 | |
| D. | 乙烯水化法制乙醇--取代 |
| A. | a:Fe b:FeCl3 c:FeCl2 | B. | a:AlCl3 b:Al(OH)3 c:Al2O3 | ||
| C. | a:N2 b:NH3 c:NO2 | D. | a:SO2 b:SO3 c:H2SO4 |
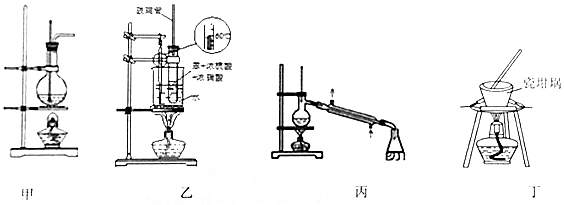
| A. | 装置甲:实验室中可用此装置来制备乙酸乙酯并在烧瓶中获得产物 | |
| B. | 装置乙:实验室中可用此装置来制备硝基苯 | |
| C. | 装置丙:实验室中可用此装置来分离含碘的四氯化碳溶液,最终在锥形瓶中收集到碘 | |
| D. | 用装置丁加热熔融NaOH固体 |