题目内容
6.某硝酸的质量分数11.8%,密度为1.065g•cm-3.现在已知该硝酸的体积是400mL,铜粉的质量是9.6g.(1)计算该硝酸的物质的量浓度.
(2)假定该硝酸与铜反应只生成NO,计算在标准状况下生成的NO的体积.
分析 (1)据C=$\frac{1000ρw}{M}$求硝酸浓度;
(2)据得失电子守恒进行计算.
解答 解:(1)C=$\frac{1000ρw}{M}$=$\frac{1000×1.065×11.8%}{63}$=1.99mol/L;
答:该硝酸的物质的量浓度1.99mol/L;
(2)n(Cu)=$\frac{9.6g}{64g/mol}$=0.15mol,从Cu→Cu2+,失去的电子数为n(失e-)=0.15×2=0.3mol,硝酸从HNO3→NO,化合价有+5→+2,得到的电子数3,根据得失电子守恒的3n(NO)=0.3,即n(NO)=0.1mol,v(NO)=0.1mol×22.4L/mol=2.24L.
答:标准状况下生成的NO的体积为2.24L.
点评 解决本题的关键是会运用得失电子守恒,以及公式的记忆C=$\frac{1000ρw}{M}$,也是解决本题的关键,本题较为简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.反应2C+O2═2CO的能量变化如图所示.下列说法正确的是( )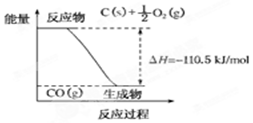

| A. | 12g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ | |
| B. | 2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ | |
| C. | 该反应的热化学方程式是2C(s)+O2(g)═2CO(g);△H=-221 kJ | |
| D. | 该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差 |
17.在25℃、1.01×105Pa下,将33gCO2通入到1000ml1.0mol•L-1的NaOH溶液中充分反应,放出xkJ热量.在该条件下1molCO2通入到2L1.0mol•L-1的NaOH溶液中充分反应,放出ykJ热量,则CO2与NaOH反应生成NaHCO3的热化学反应方程式为( )
| A. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(4x-y)kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-1/2(4x-y)kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(8x-2y)kJ•mol-1 |
14.下列说法不正确的是( )
| A. | 1molCO2含有6.02×1023个原子 | |
| B. | 1molNa2CO3的质量为106g | |
| C. | Na+的摩尔质量等于23g/mol | |
| D. | 0.012kg12C中碳原子数约为6.02×1023个 |
1.已知:a、b、c三物质间有转化关系a→b→c→a,物质间转化均只需要一步反应便能完成,则a、b、c不可能是( )
| A. | a:Fe b:FeCl3 c:FeCl2 | B. | a:AlCl3 b:Al(OH)3 c:Al2O3 | ||
| C. | a:N2 b:NH3 c:NO2 | D. | a:SO2 b:SO3 c:H2SO4 |
18.为了寻找半导体材料,应当( )
| A. | 在周期表金属与非金属区分界线附近找 | |
| B. | 在周期表左下方找 | |
| C. | 在周期表右上方找 | |
| D. | 在过渡元素中找 |
15.下列实验方案能达到实验目的是( )
| 实验目的 | 实验方案 | |
| A | 检验Na2SO3晶体是否已氧化变质 | 将Na2SO3样品溶于稀硝酸后,滴加BaCl2溶液,观察是否有沉淀生成 |
| B | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| C | 制备氢氧化铁胶体 | 向沸水中滴加氯化铁稀溶液,继续煮沸至溶液呈红褐色 |
| D | 证明Mg(OH)2沉淀可转化为Fe(OH)3沉淀 | 向2mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| A. | A | B. | B | C. | C | D. | D |