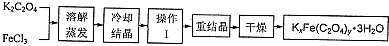
题目内容
7.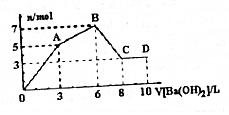 向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/LBa(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所所得沉淀的量的关系如图,下列说法不正确的是( )
向Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/LBa(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所所得沉淀的量的关系如图,下列说法不正确的是( )| A. | 图中C点铝元素存在的形式是AlO2- | |
| B. | 原混合溶液中c[Al2(SO4)3]:c(AlCl3)=1:2 | |
| C. | 向D点溶液中通入过量CO2气体,最终将得到9mol沉淀 | |
| D. | OA段反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4 |
分析 向含Al2(SO4)3 和 AlCl3的混合溶液与Ba(OH)2溶液反应的实质是Al3+与OH-、Ba2+与SO42-之间的离子反应,如下:
Ba2++SO42-═BaSO4↓,Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O,
假设1molAl2(SO4)3中SO42-完全被沉淀所需Ba(OH)2量为3mol,提供6molOH-,1molAl2(SO4)3中含有2molAl3+,由反应Al3++3OH-═Al(OH)3↓可知,2molAl3+完全沉淀,需要6molOH-,则:
从起点到A点,可以认为是硫酸铝与氢氧化钡恰好发生反应生成硫酸钡、氢氧化铝沉淀,A点时SO42-完全沉淀,
A-B为氯化铝与氢氧化钡的反应,B点时溶液中Al3+完全沉淀,产生沉淀达最大值,溶液中溶质为BaCl2,
B-C为氢氧化铝与氢氧化钡反应,C点时氢氧化铝完全溶解,
A.C点时氢氧化铝完全溶解;
B.前3LBa(OH)2溶液与溶液中Al2(SO4)3反应,从3L-6L为Ba(OH)2溶液与溶液中AlCl3反应,据此计算;
C.根据Al盐酸守恒可知D点的溶液中含有4molAlO2-,通入过量二氧化碳后生成沉淀为氢氧化铝,应该为4mol;
D.OA段实质为Ba(OH)2溶液与溶液中Al2(SO4)3反应.
解答 解:向含Al2(SO4)3 和 AlCl3的混合溶液与Ba(OH)2溶液反应的实质是Al3+与OH-、Ba2+与SO42-之间的离子反应,如下:Ba2++SO42-═BaSO4↓,Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O,
假设1molAl2(SO4)3中SO42-完全被沉淀所需Ba(OH)2量为3mol,提供6molOH-,1molAl2(SO4)3中含有2molAl3+,由反应Al3++3OH-═Al(OH)3↓可知,2molAl3+完全沉淀,需要6molOH-,故:
从起点到A点,可以认为是硫酸铝与氢氧化钡恰好发生反应生成硫酸钡、氢氧化铝沉淀,A点时SO42-完全沉淀,
A-B为氯化铝与氢氧化钡的反应,B点时溶液中Al3+完全沉淀,产生沉淀达最大值,溶液中溶质为BaCl2,
B-C为氢氧化铝与氢氧化钡反应,C点时氢氧化铝完全溶解,
A.C点时氢氧化铝完全溶解,转化为偏铝酸盐,故C点铝元素存在形式是AlO2-,故A正确;
B.前3LBa(OH)2溶液与溶液中Al2(SO4)3反应,从3L-6L为Ba(OH)2溶液与溶液中AlCl3反应,二者消耗的氢氧化钡的物质的量相等为3L×1mol/L=3mol,由生成硫酸钡可知3n[Al2(SO4)3]=n[Ba(OH)2],故n[Al2(SO4)3]=1mol,由氯化铝与氢氧化钡生成氢氧化铝可知3n(AlCl3)=2[Ba(OH)2]=6mol,故n(AlCl3)=2mol,故原溶液中原混合液中c[Al2(SO4)3]:c(AlCl3)=1:2,故B正确;
C.D点的溶液中含有4molAlO2-,通入过量二氧化碳后生成的沉淀只有氢氧化铝,根据Al盐酸守恒最终生成沉淀为4mol,故C错误;
D、OA段实质为硫酸铝与氢氧化钡恰好发生反应生成硫酸钡、氢氧化铝沉淀,反应离子方程式为:3Ba2++2Al3++6OH-+3SO42-=3BaSO4↓+2Al(OH)3↓,故D正确;
故选C.
点评 本题考查化合物反应的计算,题目难度中等,明确图象曲线变化的含义为解答关键,试题有利于培养学生的分析能力及化学计算能力.

| A. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(4x-y)kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-1/2(4x-y)kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(8x-2y)kJ•mol-1 |
| A. | 在周期表金属与非金属区分界线附近找 | |
| B. | 在周期表左下方找 | |
| C. | 在周期表右上方找 | |
| D. | 在过渡元素中找 |
| 实验目的 | 实验方案 | |
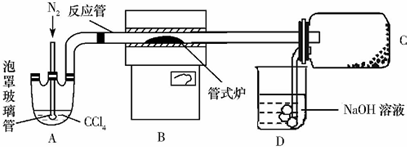
| A | 检验Na2SO3晶体是否已氧化变质 | 将Na2SO3样品溶于稀硝酸后,滴加BaCl2溶液,观察是否有沉淀生成 |
| B | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| C | 制备氢氧化铁胶体 | 向沸水中滴加氯化铁稀溶液,继续煮沸至溶液呈红褐色 |
| D | 证明Mg(OH)2沉淀可转化为Fe(OH)3沉淀 | 向2mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| A. | A | B. | B | C. | C | D. | D |
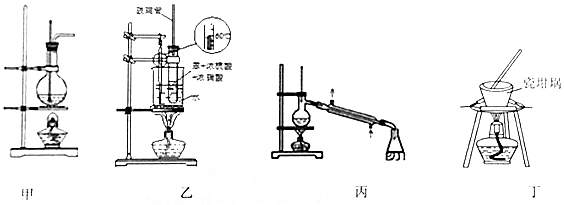
| A. | 装置甲:实验室中可用此装置来制备乙酸乙酯并在烧瓶中获得产物 | |
| B. | 装置乙:实验室中可用此装置来制备硝基苯 | |
| C. | 装置丙:实验室中可用此装置来分离含碘的四氯化碳溶液,最终在锥形瓶中收集到碘 | |
| D. | 用装置丁加热熔融NaOH固体 |
| A. | 氢化物的稳定性:B>C | |
| B. | 氢化物的沸点:B>C | |
| C. | 最高价氧化物对应的水化物的酸性:B>D | |
| D. | A、B、C、D形成的单质最多有6 种 |