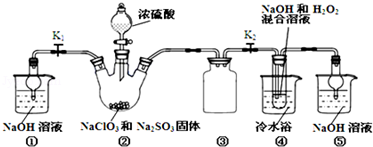
题目内容
10. 卤族元素是典型的非金属元素,单质及其化合物在工农业生产和生活中有重要的用途.
卤族元素是典型的非金属元素,单质及其化合物在工农业生产和生活中有重要的用途. (1)同主族元素的电负性大小存在一定的规律,卤族元素(F、Cl、Br、I)中,电负性最大的是F.
(2)不同卤素原子之间可形成卤素互化物,如IBr、BrI3、BrF5、IF,等.卤素互化物中的化学键类型是 (填标号)AD.A.极性键 B.非极性键 C.离子键 D.σ键
(3)BeCl2的分子空间构型为直线型;BF3分子中B-F键的键角为120°.
(4)NF3分子中的N原子的杂化方式为sp3.
(5)HF的相对分子质量小于HC1,但其沸点却高于HC1,其原因是HF分子间存在氢键,而HC(1分)子间不存在氢键
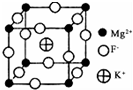
(6)由F、Mg、K三种元素形成的某种晶体的晶胞结构如下图所示,晶胞边长为anm,该晶体的化学式为KMgF3;列式计算该晶体的密度(g•cm-3)$\frac{0.1993}{{a}^{3}}$.
分析 (1)同主族自上而下电负性减小;
(2)均属于分子晶体,原子之间通过共用电子对形成,属于极性键与σ 键;
(3)BeCl2的分子中Be原子形成2个σ 键、没有孤对电子,为直线型结构; BF3分子中形成3个σ 键、没有孤对电子,为平面正三角形构型;
(4)NF3分子中中心原子形成3个σ 键、有1个孤对电子;
(5)HF分子之间形成氢键,沸点高于HCl的;
(6)白色数目为12×$\frac{1}{4}$=3、黑色球数目为8×$\frac{1}{8}$=1、另外离子数目为1,由化合价代数和为0,可知白色球为氟离子,进而确定化学式,计算晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)同主族自上而下电负性减小,故F的电负性最大,故答案为:F;
(2)均属于分子晶体,原子之间通过共用电子对形成,属于极性键与σ 键,故选:AD;
(3)BeCl2的分子中Be原子形成2个σ 键、没有孤对电子,为直线型结构; BF3分子中形成3个σ 键、没有孤对电子,为平面正三角形构型,键角为120°,故答案为:直线型;120°;
(4)NF3分子中中心原子形成3个σ 键、有1个孤对电子,则为sp3杂化,故答案为:sp3;
(5)HF存在分子间氢键,而HCl不存在分子间氢键,故HF的沸点高于HCl的,故答案为:HF分子间存在氢键,而HC(1分)子间不存在氢键;
(6)白色数目为12×$\frac{1}{4}$=3、黑色球数目为8×$\frac{1}{8}$=1、另外离子数目为1,由化合价代数和为0,可知白色球为氟离子,故该化合物化学式为:KMgF3,晶胞质量为$\frac{39+24+19×3}{6.02×1{0}^{23}}$g,晶胞边长为anm(1nm=10-9m),该晶体的密度为 $\frac{39+24+19×3}{6.02×1{0}^{23}}$g÷(a×10-7 cm)3=$\frac{0.1993}{{a}^{3}}$g.cm-3,
故答案为:KMgF3;$\frac{0.1993}{{a}^{3}}$.
点评 本题是对物质结构与性质的考查,涉及电负性、化学键、杂化方式与空间构型判断、氢键、晶胞计算等,注意氢键对物质性质的影响,掌握均摊法进行晶胞有关计算,难度中等.

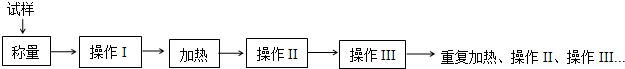
回答下列问题:
(1)实验已有仪器:电子天平、酒精灯、铁三脚架,从下列仪器中选出实验还需要的仪器A、B、E、F、G(用标号字母填写)
A.干燥器 B.研钵 C.试管夹 D.蒸发皿 E.坩埚 F.玻璃棒 G.药匙
除上述列出的仪器外,还需要的仪器是泥三角、坩埚钳.
(2)某学生在实验中得到数据如表.据此计算 x=5.9(精确到0.1)
| 加热前质量 | 加热后质量 | ||
| m1 | m2 | m3 | m4 |
| 5.400g | 7.900g | 6.900g | 6.901g |
a.加热前称量时容器未完全干燥
b.最后两次加热后的质量相差较大
c.加热后容器未放入干燥器中冷却
d.加热过程中有少量溅失.
| A. | 称量样品→加热→冷却→称量CuO | |
| B. | 称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量 | |
| C. | 称量样品→加热→冷却→称量Cu(NO3)2 | |
| D. | 称量样品→加NaOH→过滤→加热→冷却→称量CuO |

| A. | 氮气和氢气 | B. | 催化剂 | C. | NH3 | D. | H2 |
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
| A. | 仅能表示化学反应中伴随放出热量多少的化学方程式 | |
| B. | 能够表示化学反应中热效应的化学方程式 | |
| C. | 热效应的大小与反应的温度、压强无关,只与反应物和生成物的状态有关 | |
| D. | 当多步反应中热化学方程式相加时,相对应的热量要相减 |
| A. | 升高温度,正向反应速率减小,逆向反应速率增大 | |
| B. | 升高温度有利于正、逆反应速率增大,从而缩短达到平衡的时间 | |
| C. | 达到平衡后,升高温度或增大压强都有利于该反应平衡逆向移动 | |
| D. | 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |