题目内容
11.有①${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O②H2、D2、T2 ③石墨、金刚石 ④${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H四组微粒或物质.回答下列问题:(1)互为同位素的是①④(填编号).
(2)由①和④中微粒结合形成的水分子种类有18种.
分析 (1)有相同质子数,不同中子数的原子或同一元素的不同核素互为同位素;
(2)氢原子有三种同位素H、D、T,氧原子有三种同位素168O、178O和188O,依此判断水分子的种数.
解答 解:①168O、178O和188O质子数相同,中子数不同,故互为同位素;
②H2、D2、T2 是由氢的同位素原子构成的氢分子,既不是同位素,也不是同素异形体;
③石墨、金刚石都是由碳元素形成的不同单质,互为同素异形体;
④${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H质子数相同,中子数不同,故互为同位素;
(1)互为同位素的是:①④,
故答案为:①④;
(2)氢原子有三种同位素H、D、T,氧原子有三种同位素168O、178O和188O,水分子是由2个氢原子和1个氧原子构成的,故水分子有2×3×3=18种,
故答案为:18.
点评 本题考查同位素、同素异形体的概念,难度不大,对于元素、核素、同位素、同素异形体、同分异构体、同系物、同种物质等概念的区别是考试的热点问题.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
1.下列物质中,既能与盐酸又能与氢氧化钠溶液反应,且均有气体生成的化合物是( )
| A. | Si | B. | NH4HCO3 | C. | Al | D. | Al2O3 |
19.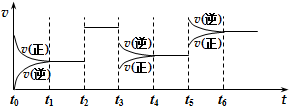 某密闭容器中发生如下反应:2X(g)+Y(g)?Z(g)△H<0.下图是表示该反应速率(v)随时间(t)变化的关系图.t2、t3、t5时刻外界条件均有改变(但都没有改变各物质的用量).则下列说法中不正确的是( )
某密闭容器中发生如下反应:2X(g)+Y(g)?Z(g)△H<0.下图是表示该反应速率(v)随时间(t)变化的关系图.t2、t3、t5时刻外界条件均有改变(但都没有改变各物质的用量).则下列说法中不正确的是( )
 某密闭容器中发生如下反应:2X(g)+Y(g)?Z(g)△H<0.下图是表示该反应速率(v)随时间(t)变化的关系图.t2、t3、t5时刻外界条件均有改变(但都没有改变各物质的用量).则下列说法中不正确的是( )
某密闭容器中发生如下反应:2X(g)+Y(g)?Z(g)△H<0.下图是表示该反应速率(v)随时间(t)变化的关系图.t2、t3、t5时刻外界条件均有改变(但都没有改变各物质的用量).则下列说法中不正确的是( )| A. | t3时减小了压强 | |
| B. | t5时增大了压强 | |
| C. | t6时刻后反应物的转化率最低 | |
| D. | t1时该反应的平衡常数大于 t6时反应的平衡常数 |
6.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm).
(1)用元素符号标出它们在周期表中对应位置(以下为周期表的一部分).
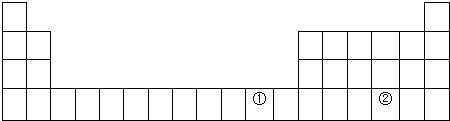
(2)①元素处于元素周期表中四周期IB族;写出该元素(Cu)单质在空气中生锈的方程式2Cu+O2+CO2+H2O=Cu2(OH)2CO3;
(3)A的离子结构示意图为 .B的氧化物溶于氢氧化钠溶液的方程式为Al2O3+2NaOH+3=2NaAlO2+H2O;
.B的氧化物溶于氢氧化钠溶液的方程式为Al2O3+2NaOH+3=2NaAlO2+H2O;
(4)用一个化学方程式证明C、D元素非金属性强弱Cl2+H2S=S↓+2HCl;
(5)元素②与C的最高价含氧酸酸性由强到弱顺序为H2SO4>H2SeO4.(用化学式表示)
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |

(2)①元素处于元素周期表中四周期IB族;写出该元素(Cu)单质在空气中生锈的方程式2Cu+O2+CO2+H2O=Cu2(OH)2CO3;
(3)A的离子结构示意图为
 .B的氧化物溶于氢氧化钠溶液的方程式为Al2O3+2NaOH+3=2NaAlO2+H2O;
.B的氧化物溶于氢氧化钠溶液的方程式为Al2O3+2NaOH+3=2NaAlO2+H2O;(4)用一个化学方程式证明C、D元素非金属性强弱Cl2+H2S=S↓+2HCl;
(5)元素②与C的最高价含氧酸酸性由强到弱顺序为H2SO4>H2SeO4.(用化学式表示)
16.下列叙述错误的是( )
| A. | 通常情况下,甲烷和强酸、强碱、强氧化剂不起反应 | |
| B. | 光照下甲烷与氯气发生取代反应 | |
| C. | 甲烷的氯代物CHCl3、CCl4都难溶于水 | |
| D. | 甲烷在光照条件下与氧气反应 |
20.下列各项叙述中正确的是( )
| A. | 在同一个电子层上运动的电子,其自旋方向肯定不同 | |
| B. | 杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 | |
| C. | 物质的键能越大,该物质本身具有的能量越低 | |
| D. | 在周期表中原子的族序数等于它的最外层电子数 |
1.已知反应3O2(g)=2O3(g)的△H<0、△S<0,对此反应叙述正确的是( )
| A. | 该反应在任何情况下均能自发进行 | |
| B. | 该反应在任何情况下均不能自发进行 | |
| C. | 该反应在一定条件下能自发进行 | |
| D. | 条件不足,无法判断 |
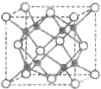 元素X基态原子核外电子数为29,元素Y位于X的前一周期且最外层电子数为1,元素Z基态原子3p轨道上有4个电子,元素P原子最外层电子数是其内层电子数的3倍,元素Q基态原子2p半充满.请回答下列问题:
元素X基态原子核外电子数为29,元素Y位于X的前一周期且最外层电子数为1,元素Z基态原子3p轨道上有4个电子,元素P原子最外层电子数是其内层电子数的3倍,元素Q基态原子2p半充满.请回答下列问题: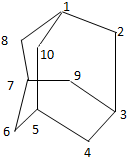 有的油田开采的石油中溶有一种碳氢化合物-金刚烷.
有的油田开采的石油中溶有一种碳氢化合物-金刚烷.