题目内容
16.下列叙述错误的是( )| A. | 通常情况下,甲烷和强酸、强碱、强氧化剂不起反应 | |
| B. | 光照下甲烷与氯气发生取代反应 | |
| C. | 甲烷的氯代物CHCl3、CCl4都难溶于水 | |
| D. | 甲烷在光照条件下与氧气反应 |
分析 A.通常情况下甲烷不与强酸、强碱和强氧化剂反应;
B.有机化合物分子里的某些原子或原子团被其它原子或原子团所代替的反应;
C.CHCl3、CCl4都难溶于水;
D.甲烷在光照条件下不与氧气反应.
解答 解:A.通常情况下甲烷不与强酸、强碱和强氧化剂反应,故A正确;
B.甲烷中的氢原子被氯原子所取代,属于取代反应,故B正确;
C.CHCl3、CCl4都难溶于水,故C正确;
D.甲烷在光照条件下不与氧气反应,点燃条件下能反应,故D错误.
故选D.
点评 本题考查甲烷的化学性质,难度不大,注意基础知识的积累.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
6.短周期元素R、X、Y、Z原子序数依次增大,其中R的气态氢化物的水溶液呈碱性,X是同周期中原子半径最大的元素,Y的单质是一种常见的半导体材料,Y与Z的原子序数相差3,下列判断正确的是( )
| A. | 最外层电子数:Z>R>Y | |
| B. | 气态氢化物的稳定性:Y>Z | |
| C. | R、X的氧化物均为离子化合物 | |
| D. | Z的氢化物水溶液和Y最高价氧化物对应的水化物能相互反应 |
7.(1)已知25℃时有关弱酸的电离平衡常数:
①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为cbda(填序号).
②若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是a(填序号).
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数.
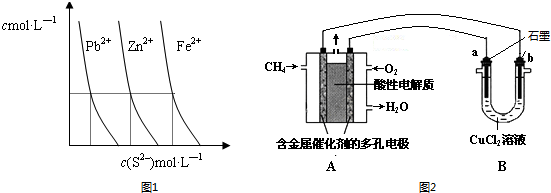
(2)如图1为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.如果向三种沉淀中加盐酸,最先溶解的是FeS(填化学式).向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为PbS(填化学式)沉淀.
(3)甲烷燃料电池可以提升能量利用率.图2是利用甲烷燃料电池电解50mL2mol•L-1的氯化铜溶液的装置示意图:
请回答:
①甲烷燃料电池的负极反应式是CH4-8e-+2H2O=CO2+8H+.
②当线路中有0.1mol电子通过时b极(填a、b)增重3.2g.
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
②若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是a(填序号).
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数.
(2)如图1为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.如果向三种沉淀中加盐酸,最先溶解的是FeS(填化学式).向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为PbS(填化学式)沉淀.
(3)甲烷燃料电池可以提升能量利用率.图2是利用甲烷燃料电池电解50mL2mol•L-1的氯化铜溶液的装置示意图:
请回答:
①甲烷燃料电池的负极反应式是CH4-8e-+2H2O=CO2+8H+.
②当线路中有0.1mol电子通过时b极(填a、b)增重3.2g.

8.在某温度下,可逆反应mA(g)+nB(g)?pC(g)+qD(g)的平衡常数为K,下列说法正确的是( )
| A. | K越大,达到平衡时,反应进行的程度越大 | |
| B. | K随反应物浓度的改变而改变 | |
| C. | K越小,达到平衡时,反应物的转化率越大 | |
| D. | K随温度和压强的改变而改变 |
 ;取代反应
;取代反应 ;加成反应
;加成反应 ;取代反应
;取代反应 某同学在画某种元素的一种单核微粒的结构的示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构的示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断. .
.