题目内容
19.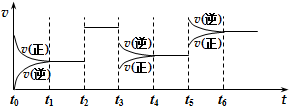 某密闭容器中发生如下反应:2X(g)+Y(g)?Z(g)△H<0.下图是表示该反应速率(v)随时间(t)变化的关系图.t2、t3、t5时刻外界条件均有改变(但都没有改变各物质的用量).则下列说法中不正确的是( )
某密闭容器中发生如下反应:2X(g)+Y(g)?Z(g)△H<0.下图是表示该反应速率(v)随时间(t)变化的关系图.t2、t3、t5时刻外界条件均有改变(但都没有改变各物质的用量).则下列说法中不正确的是( )| A. | t3时减小了压强 | |
| B. | t5时增大了压强 | |
| C. | t6时刻后反应物的转化率最低 | |
| D. | t1时该反应的平衡常数大于 t6时反应的平衡常数 |
分析 t2时刻,改变条件时,正逆反应速率都增大且仍然相等,说明平衡不移动,该反应前后气体计量数之和改变,所以改变的条件只能是催化剂;
t3时刻,改变条件时,正逆反应速率都减小,且逆反应速率大于正反应速率,平衡逆向元素,该反应的正反应是放热反应,则改变的条件应该是压强;
t5时刻,改变条件时,正逆反应速率都增大,正反应速率大于逆反应速率,平衡正向移动,改变的条件应该是温度.
解答 解:t2时刻,改变条件时,正逆反应速率都增大且仍然相等,说明平衡不移动,该反应前后气体计量数之和改变,所以改变的条件只能是加入催化剂;
t3时刻,改变条件时,正逆反应速率都减小,且逆反应速率大于正反应速率,平衡逆向元素,该反应的正反应是放热反应,则改变的条件应该是降低压强;
t5时刻,改变条件时,正逆反应速率都增大,正反应速率大于逆反应速率,平衡正向移动,改变的条件应该是升高温度,
A.通过以上分析知,t3 时减小了压强,故A正确;
B.通过以上分析知,t5 时升高温度,故B错误;
C.t2时刻平衡不移动,t3、t5时刻平衡逆向移动,所以t6时刻后参加反应的反应物物质的量最少,则反应物的转化率最低,故C正确;
D.该反应的正反应是放热反应,升高温度,平衡常数减小,t1-t2时温度小于t6时,所以t1时该反应的平衡常数大于 t6时反应的平衡常数,故D正确;
故选B.
点评 本题考查图象分析,为高频考点,题目难度中等,侧重考查学生分析判断能力,明确外界条件对反应速率影响、平衡移动影响即可解答,难点是平衡移动原理的灵活运用.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
9.下列叙述中错误的是( )
| A. | H2在Cl2中燃烧、H2与Cl2的混合气体光照发生爆炸,都放出热量 | |
| B. | H2在O2中燃烧生成H2O放出能量,H2O分解为H2和O2吸收能量 | |
| C. | 氙和氟按一定比例混合,在一定条件下可直接发生反应:Xe+2F2═XeF4,该反应过程中Xe和F2都有化学键断裂 | |
| D. | 在CaO+H2O═Ca(OH)2的过程中CaO和H2O的总能量高于Ca(OH)2的总能量 |
7.(1)已知25℃时有关弱酸的电离平衡常数:
①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为cbda(填序号).
②若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是a(填序号).
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数.
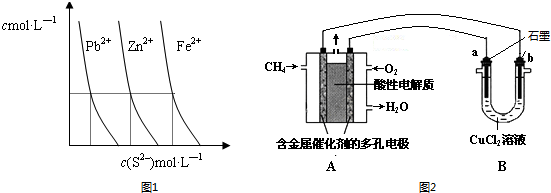
(2)如图1为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.如果向三种沉淀中加盐酸,最先溶解的是FeS(填化学式).向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为PbS(填化学式)沉淀.
(3)甲烷燃料电池可以提升能量利用率.图2是利用甲烷燃料电池电解50mL2mol•L-1的氯化铜溶液的装置示意图:
请回答:
①甲烷燃料电池的负极反应式是CH4-8e-+2H2O=CO2+8H+.
②当线路中有0.1mol电子通过时b极(填a、b)增重3.2g.
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
②若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是a(填序号).
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数.
(2)如图1为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.如果向三种沉淀中加盐酸,最先溶解的是FeS(填化学式).向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为PbS(填化学式)沉淀.
(3)甲烷燃料电池可以提升能量利用率.图2是利用甲烷燃料电池电解50mL2mol•L-1的氯化铜溶液的装置示意图:
请回答:
①甲烷燃料电池的负极反应式是CH4-8e-+2H2O=CO2+8H+.
②当线路中有0.1mol电子通过时b极(填a、b)增重3.2g.

14.下列物质中,加入少量硝酸酸化的AgNO3溶液,能得到沉淀的是( )
| A. | C2H5Br | B. | 氯水 | C. | 溴的CCl4溶液 | D. | KClO3溶液 |
8.在某温度下,可逆反应mA(g)+nB(g)?pC(g)+qD(g)的平衡常数为K,下列说法正确的是( )
| A. | K越大,达到平衡时,反应进行的程度越大 | |
| B. | K随反应物浓度的改变而改变 | |
| C. | K越小,达到平衡时,反应物的转化率越大 | |
| D. | K随温度和压强的改变而改变 |
9.某溶液中含H+、SO42-、NO3-三种离子,其中H+、SO42-的物质的量浓度分别为7.0mol•L-1和2.0mol•L-1.取该溶液20mL,加入3.2g铜粉,加热使它们充分反应,产生的气体在标准状况下的体积约为( )
| A. | 0.75 L | B. | 0.336 L | C. | 1.5 L | D. | 0.448 L |
 短周期元素A、B、C、D、E的原子序数依次增大,且原子最外层电子数之和为17.A是元素周期表中原子半径最小的元素,B原子的最外层电子数是其次最外层电子数的2倍,A与E同主族,D原子核外有2个未成对电子.
短周期元素A、B、C、D、E的原子序数依次增大,且原子最外层电子数之和为17.A是元素周期表中原子半径最小的元素,B原子的最外层电子数是其次最外层电子数的2倍,A与E同主族,D原子核外有2个未成对电子. ;取代反应
;取代反应 ;加成反应
;加成反应 ;取代反应
;取代反应