题目内容
7.用酸式滴定管准确移取10.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20mol•L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.50mL | 18.60mL |
| 第二次 | 0.70mL | 19.00mL |
(2)达到滴定终点的标志是无色变为红色,且30s内不变色.
(3)以下操作造成测定结果偏高的原因可能是AD.
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液.
分析 (1)结合V(NaOH)=$\frac{(18.60-0.5)+(19.00-0.7)}{2}$=18.2mL、c(HCl)=$\frac{V(NaOH)c(NaOH)}{V(HCl)}$计算;
(2)碱滴定酸,使用酚酞作指示剂,开始为无色,滴定终点为红色;
(3)结合c(HCl)=$\frac{V(NaOH)c(NaOH)}{V(HCl)}$及不当操作使V(NaOH)偏大,则测定结果偏高,以此来解答.
解答 解:(1)由表格数据可知V(NaOH)=$\frac{(18.60-0.5)+(19.00-0.7)}{2}$=18.2mL、c(HCl)=$\frac{V(NaOH)c(NaOH)}{V(HCl)}$=$\frac{0.2mol/L×0.0182L}{0.01L}$=0.364mol/L,
故答案为:0.364;
(2)碱滴定酸,使用酚酞作指示剂,开始为无色,滴定终点为红色,则达到滴定终点的标志是无色变为红色,且30s内不变色,
故答案为:无色变为红色,且30s内不变色;
(3)A.未用标准液润洗碱式滴定管,消耗V(NaOH)偏大,由c(HCl)=$\frac{V(NaOH)c(NaOH)}{V(HCl)}$可知,测定结果偏高,故A选;
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确,V(NaOH)偏小,由c(HCl)=$\frac{V(NaOH)c(NaOH)}{V(HCl)}$可知,测定结果偏低,故B不选;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,HCl的物质的量不变,消耗NaOH的物质的量不变,对实验无影响,故C不选;
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液.V(NaOH)偏大,由c(HCl)=$\frac{V(NaOH)c(NaOH)}{V(HCl)}$可知,测定结果偏高,故D选;
故答案为:AD.
点评 本题考查中和滴定实验,为高频考点,把握滴定原理、数据处理、误差分析为解答的关键,侧重分析与实验能力的考查,注意结合实验中不当操作分析误差,题目难度不大.

| A. | 电子数 | B. | 质量 | C. | 原子数 | D. | 氮原子数 |
| A. | I | B. | Fe | C. | Ca | D. | Na |
| A. | 在合成氨工业中,加压有利于提高NH3的产率 | |
| B. | 直接燃烧煤不如将煤进行深加工后再燃烧的效率好 | |
| C. | 化石燃料包括石油、天然气、煤和氢能 | |
| D. | 在时间允许的情况下,从节能上分析,步行>坐公交>坐出租车 |
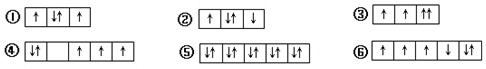
| A. | ①②③ | B. | ④⑤⑥ | C. | ②④⑥ | D. | ③④⑥ |

 ,K的结构简式为
,K的结构简式为 .
.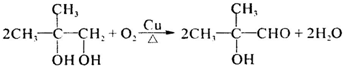 .
. $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. 以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向.
以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向.