题目内容
19.以下列出的是一些基态原子的2p轨道和3d轨道中电子排布的情况,违反洪特规则的有( )
| A. | ①②③ | B. | ④⑤⑥ | C. | ②④⑥ | D. | ③④⑥ |
分析 洪特规则:在同一个电子亚层中排布的电子,总是尽先占据不同的轨道,且自旋方向相同,以此进行判断.
解答 解:①2p能层有4个电子,应在3个不同的轨道,符合洪特规则、泡利不相容原理;
②2p能层有4个电子,图示不同轨道的单电子自旋方向不同,违反了洪特规则;
③2p能层有4个电子,同一个原子轨道中不应有自旋状态相同的电子,违反了泡利原理;
④3d能级中有5个不同的轨道,对于基态原子,电子在能量相同的轨道上排布时,将尽可能分占不同的轨道并且自旋状态相同,违反了洪特规则;
④3d能级中有5个不同的轨道,有10个电子,符合洪特规则、泡利不相容原理;
⑤3d能级中有5个不同的轨道,有6个电子,图示不同轨道的单电子自旋方向不同,违反了洪特规则;
故选:C.
点评 本题考查原子核外电子的排布,题目难度不大,注意泡利原理、洪特规则的内容即可解答该题,学习中注意相关基础知识的积累.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
9.按要求回答下列问题:
(1)填写表空格中,物质类别所对应的官能团名称或结构简式
(2)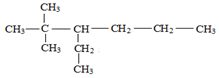 的名称为2,2-二甲基-3-乙基己烷.
的名称为2,2-二甲基-3-乙基己烷.
(3)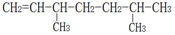 的名称为2,5-二甲基-1-庚烯.
的名称为2,5-二甲基-1-庚烯.
(4)2,4,6-三硝基甲苯(TNT)的结构简式为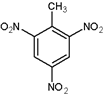 .
.
(1)填写表空格中,物质类别所对应的官能团名称或结构简式
| 物质类别 | 烯烃 | 酚 | 醛 | 硝基化合物 |
| 官能团名称 | 碳碳双键 | 羟基 | 醛基 | 硝基 |
| 结构简式 |  | -OH | -CHO | -NO2 |
 的名称为2,2-二甲基-3-乙基己烷.
的名称为2,2-二甲基-3-乙基己烷.(3)
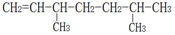 的名称为2,5-二甲基-1-庚烯.
的名称为2,5-二甲基-1-庚烯.(4)2,4,6-三硝基甲苯(TNT)的结构简式为
 .
.
7.用酸式滴定管准确移取10.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20mol•L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
(1)根据以上数据可以计算出盐酸的物质的量浓度为0.364mol•L-1.
(2)达到滴定终点的标志是无色变为红色,且30s内不变色.
(3)以下操作造成测定结果偏高的原因可能是AD.
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液.
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.50mL | 18.60mL |
| 第二次 | 0.70mL | 19.00mL |
(2)达到滴定终点的标志是无色变为红色,且30s内不变色.
(3)以下操作造成测定结果偏高的原因可能是AD.
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液.
14. 阅读分析下列材料:
阅读分析下列材料:
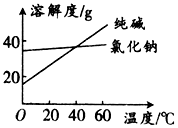
材料1:纯碱和氯化钠溶解度随温度变化的曲线图:
材料2:两种有机物的物理性质:
(1)将纯碱从氯化钠和纯碱的混合物中分离出来,合适的方法是C(填字母,下同);将乙二醇和丙三醇混合液相互分离的最佳方法是:蒸馏.
A、萃取 B、蒸馏 C、溶解、蒸发浓缩、冷却结晶、过滤 D、分液
(2)某纯碱样品中可能含有氯化钠,设计一个简易实验加以证明:取样品少许于试管中,加入蒸馏水溶解,加入硝酸酸化的硝酸银溶液.出现白色沉淀,证明含有氯化钠 (写出简要操作方法、现象和结论)
(3)某同学设计两套方案测定纯碱样品(含少量的氯化钠)中碳酸钠的质量分数.
方案1:取mg纯碱样品,加入过量的盐酸,充分反应后,蒸发、灼烧、称重得bg固体,计算出纯碱样品纯度.
方案2:取mg纯碱样品,溶于水加入过量的氯化钙溶液,过滤、洗涤、烘干、称重得ag固体,计算出纯碱样品纯度.
①写出方案1涉及的反应的化学方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
②利用方案2中的数据计算该纯碱的纯度:$\frac{53a}{50m}$×100%.
 阅读分析下列材料:
阅读分析下列材料:材料1:纯碱和氯化钠溶解度随温度变化的曲线图:
材料2:两种有机物的物理性质:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇 C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇及其他有机溶剂 |
| 丙三醇 C3H8O3 | 17.9 | 290 | 1.26 | 能跟水和酒精以任意比互溶;易溶于其他有机溶剂 |
A、萃取 B、蒸馏 C、溶解、蒸发浓缩、冷却结晶、过滤 D、分液
(2)某纯碱样品中可能含有氯化钠,设计一个简易实验加以证明:取样品少许于试管中,加入蒸馏水溶解,加入硝酸酸化的硝酸银溶液.出现白色沉淀,证明含有氯化钠 (写出简要操作方法、现象和结论)
(3)某同学设计两套方案测定纯碱样品(含少量的氯化钠)中碳酸钠的质量分数.
方案1:取mg纯碱样品,加入过量的盐酸,充分反应后,蒸发、灼烧、称重得bg固体,计算出纯碱样品纯度.
方案2:取mg纯碱样品,溶于水加入过量的氯化钙溶液,过滤、洗涤、烘干、称重得ag固体,计算出纯碱样品纯度.
①写出方案1涉及的反应的化学方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
②利用方案2中的数据计算该纯碱的纯度:$\frac{53a}{50m}$×100%.
4.第四周期过渡元素常与H2O、NH3、CN-等形成配合物.
(1)Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,形成配位数为6的配合物,写出该配合物的化学式K4[Fe(CN)6].
(2)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般地,为do或d10排布时,无颜色;为d1一d9排布时,有颜色,如[Co(H2O)6]2+显粉红色.据此判断,[Mn(H2O)6]2+有颜色(填“无”或“有”).[Mn(H2O)6]2+配离子中存在的化学键有CD (填标号)
A.金属键 B.离子键 C.共价键 D.配位键
(3)H2S和H2O2的主要物理性质比较如表:
①H2O2分子中O原子采取sp3杂化,写出H2O2的电子式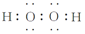
②H2S和H2O2的相对分子质量相同,造成沸点差异的主要原因是H2O2分子间形成氢键;造成溶解度差异的主要原因是H2O2分子与H2O分子间形成氢键.
(1)Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,形成配位数为6的配合物,写出该配合物的化学式K4[Fe(CN)6].
(2)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般地,为do或d10排布时,无颜色;为d1一d9排布时,有颜色,如[Co(H2O)6]2+显粉红色.据此判断,[Mn(H2O)6]2+有颜色(填“无”或“有”).[Mn(H2O)6]2+配离子中存在的化学键有CD (填标号)
A.金属键 B.离子键 C.共价键 D.配位键
(3)H2S和H2O2的主要物理性质比较如表:
| 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 202 | 2.6 |
| H2O2 | 423 | 以任意比互溶 |
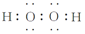
②H2S和H2O2的相对分子质量相同,造成沸点差异的主要原因是H2O2分子间形成氢键;造成溶解度差异的主要原因是H2O2分子与H2O分子间形成氢键.
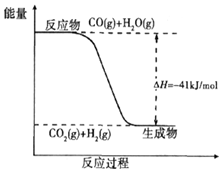 煤炭可以转化为清洁能源和化工原料.
煤炭可以转化为清洁能源和化工原料.