题目内容
20.已知常温下,Ksp[Fe(OH)2]=1×10-15、Ksp[Fe(OH)3]=1×10-38、Ksp[Cr(OH)3]=1×10-23,欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.①某含Cr2O72-废水中加入适量的绿矾(FeSO4•7H2O),加入绿矾的目的是6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O(用离子方程式表示).
②浓度为0.1mol/L Fe2+与10.0mol/L Cr3+共沉淀的pH范围是7.0~8.0.
分析 由Ksp可知,Fe(OH)3的Ksp最小,则先加绿矾与含Cr2O72-废水发生氧化还原反应,然后调节pH使离子转化为沉淀,并结合Ksp计算pH.
解答 解:①FeSO4具有还原性,可与Cr2O72-+发生氧化还原反应生成Fe3+和Cr3+,反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,
故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
②由Ksp[Fe(OH)2]=1×10-15,Fe2+开始沉淀时,c(Fe2+)=0.1mol/L,溶液的pH=7.0;完全沉淀时,c(Fe2+)=1×10-5mol/L时,溶液的pH=9.0,Ksp[Cr(OH)3]=1×10-23,c( Cr3+)=10.0mol/L时,c(OH-)=1×10-8mol/L,pH=6.0,完全沉淀时,c(Cr3+)=1×10-5mol/L时,溶液的pH=8.0,
共沉淀的pH范围是7.0~8.0,
故答案为:7.0~8.0.
点评 本题考查难溶电解质的计算,为高频考点,把握氧化还原反应、Ksp的计算为解答的关键,侧重分析与应用能力的考查,注意共沉淀时pH为解答的难点,题目难度不大.

练习册系列答案
相关题目
11.下列叙述中,正确的是( )
| A. | 1 mol H2的质量只有在标准状况下才约为2 g | |
| B. | 在标准状况下,某气体的体积是22.4 L,则可认为该气体的物质的量约是1 mol | |
| C. | 在20℃时,1 mol任何气体的体积总比22.4 L大 | |
| D. | 1 mol H2和O2的混合气体,在标准状况下的体积大于22.4 L |
15.在某一容积为2L的密闭容器内,加入 0.12mol的CO和0.12mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如下表:
(1)根据图上数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)=mol/(L•min),该温度下的平衡常数K=1.
(2)在体积不变的条件下,改变下列条件能使平衡常数变大的是A
A.升高温度 B.降低温度 C.加入催化剂 D.移出二氧化碳气体
(3)如要一开始加入0.04mol的CO、0.04mol的H2O、0.08mol的CO2和0.08mol的H2,在相同的条件下,反应达平衡时,c(CO)=0.03mol/L.
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.12mol 的水蒸气,重新达到平衡后,CO的转化率升高(填“升高”、“降低”还是“不变”),CO2的质量分数降低(填“升高”、“降低”还是“不变”).
(5)在催化剂存在和800℃的条件下,重新投料,测得在某一时刻c(CO)=c(H2O)=0.09mol/L,c(CO2 )=c(H2)=0.13mol/L,则此时v(正)<v(逆)(用“>”、“<”或“=”作答)
| 时间(min) | 0 | 5 | 10 | 15 | 20 |
| c(CO2)(mol/L) | 0.00 | 0.02 | 0.03 | 0.03 | 0.03 |
(2)在体积不变的条件下,改变下列条件能使平衡常数变大的是A
A.升高温度 B.降低温度 C.加入催化剂 D.移出二氧化碳气体
(3)如要一开始加入0.04mol的CO、0.04mol的H2O、0.08mol的CO2和0.08mol的H2,在相同的条件下,反应达平衡时,c(CO)=0.03mol/L.
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.12mol 的水蒸气,重新达到平衡后,CO的转化率升高(填“升高”、“降低”还是“不变”),CO2的质量分数降低(填“升高”、“降低”还是“不变”).
(5)在催化剂存在和800℃的条件下,重新投料,测得在某一时刻c(CO)=c(H2O)=0.09mol/L,c(CO2 )=c(H2)=0.13mol/L,则此时v(正)<v(逆)(用“>”、“<”或“=”作答)
5.如表周期表中的一部分,根据A~Ⅰ在周期表中的位置,用元素符号或化学式回答下列问题.
(1)化学性质员不活泼的元素是Ne,只有负价而无正价的元素是F,最容易与氢气反应的单质是F2,金属性最强的单质是Na.
(2)地壳中含量最多的元素是O,化合物种类最多的元素是C,与水反应最激烈的金属是Na,单质可以用于制漂白粉的元素是Cl2.
(3)在B、C、D、E、F、G、H中,原子半径最大的元素是Na
(4)A和E形成化合物的电子式是 .
.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)地壳中含量最多的元素是O,化合物种类最多的元素是C,与水反应最激烈的金属是Na,单质可以用于制漂白粉的元素是Cl2.
(3)在B、C、D、E、F、G、H中,原子半径最大的元素是Na
(4)A和E形成化合物的电子式是
 .
.
12.海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )
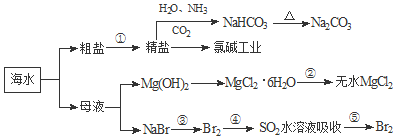

| A. | 用澄清的石灰水可鉴别NaHCO3和Na2CO3 | |
| B. | 工业生产上向母液中加石灰乳使Mg2+转化为Mg(OH)2沉淀 | |
| C. | 在第③、④、⑤步骤中,溴元素均被氧化 | |
| D. | 工业上通过电解饱和MgCl2溶液制取金属镁 |
10.粗铜中含多种杂质(如锌、金和银等),工业上常用电解精炼法将粗铜提纯,在电解精炼时( )
| A. | 精炼时粗铜接电源负极 | |
| B. | 精炼时纯铜作阴极 | |
| C. | 杂质都将以单质形式沉积到池底 | |
| D. | 纯铜片增重2.56 g,电路中通过电子为0.04 mol |
