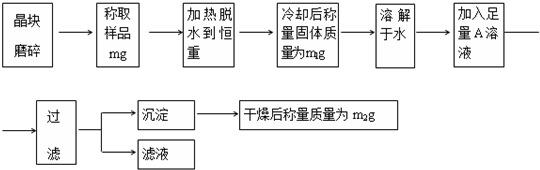
题目内容
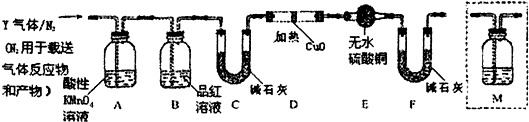
工业上可用下列装置来测定黄铁矿中硫的质量分数(忽略SO2、H2SO3与氧气的反应)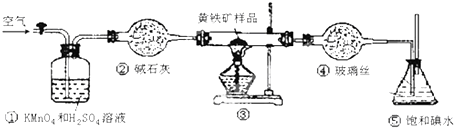
实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用300mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O=2HI+H2SO4
G.吸收液用CCl4萃取,分液
H.取20.00mL吸收液,用标准0.2000mol?L-1的NaOH溶液滴定.
试回答:
(1)已知:4FeS2+11O2=2Fe2O3+8SO2如12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的热化学方程式是 .
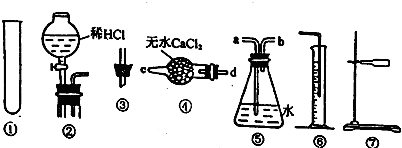
(2)步骤G中所用主要仪器是 ,应取 (填“上”或“下”)层溶液进行后续实验.
(3)装置①的作用是 .
(4)步骤H中滴定时应选用 作指示剂
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收.滴定得到的数据如表所示:
则硫铁矿样品中硫元素的质量分数为 (保留小数点后1位)
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂 .
A.硝酸银溶液 B.氯化钡溶液 C.澄清石灰水 D.酸性高锰酸钾溶液.

实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用300mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O=2HI+H2SO4
G.吸收液用CCl4萃取,分液
H.取20.00mL吸收液,用标准0.2000mol?L-1的NaOH溶液滴定.
试回答:
(1)已知:4FeS2+11O2=2Fe2O3+8SO2如12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的热化学方程式是
(2)步骤G中所用主要仪器是
(3)装置①的作用是
(4)步骤H中滴定时应选用
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收.滴定得到的数据如表所示:
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.58 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂
A.硝酸银溶液 B.氯化钡溶液 C.澄清石灰水 D.酸性高锰酸钾溶液.
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)根据12gFeS2完全燃烧放热85.3kJ,则1molFeS2(120g)完全燃烧放热853kJ,结合燃烧热的定义书写;
(2)萃取、分液的主要仪器为分液漏斗,根据滴定生成的酸在水溶液中,所以需要取上层水溶液;
(3)装置①装有酸性高锰酸钾溶液,具有强氧化性,可氧化除去空气中的还原性气体,提高实验的准确率;
(4)根据题意,用氢氧化钠滴定混合强酸溶液,所以常用的指示剂为酚酞;
(5)对于多次测量数据一般要求平均值进行数据处理,由于第一次所消耗标准液的体积与后两次相关较大,为减小误差,只求后两次标准液的体积的平均值:20.00ml,根据反应4FeS2+11O2=2Fe2O3+8SO2,I2+SO2+2H2O=2HI+H2SO4,H++OH-═H2O,得关系式S~SO2~4H+~4OH-,所以样品中硫元素的质量为:
mol×32g/mol×
=0.48g,所以样品中硫元素的质量分数为
×100%=24.0%;
(6)装置⑤所得溶液为HI、H2SO4的混合溶液,为测得硫的质量分数,最好选用能与SO42-反应生成不溶于酸性溶液的沉淀;
(2)萃取、分液的主要仪器为分液漏斗,根据滴定生成的酸在水溶液中,所以需要取上层水溶液;
(3)装置①装有酸性高锰酸钾溶液,具有强氧化性,可氧化除去空气中的还原性气体,提高实验的准确率;
(4)根据题意,用氢氧化钠滴定混合强酸溶液,所以常用的指示剂为酚酞;
(5)对于多次测量数据一般要求平均值进行数据处理,由于第一次所消耗标准液的体积与后两次相关较大,为减小误差,只求后两次标准液的体积的平均值:20.00ml,根据反应4FeS2+11O2=2Fe2O3+8SO2,I2+SO2+2H2O=2HI+H2SO4,H++OH-═H2O,得关系式S~SO2~4H+~4OH-,所以样品中硫元素的质量为:
| 0.020×0.20 |
| 4 |
| 300ml |
| 20ml |
| 0.48 |
| 2.0 |
(6)装置⑤所得溶液为HI、H2SO4的混合溶液,为测得硫的质量分数,最好选用能与SO42-反应生成不溶于酸性溶液的沉淀;
解答:
解:(1)12gFeS2完全燃烧放热85.3kJ,则根据燃烧热概念,1molFeS2(120g)完全燃烧放热853kJ,故FeS2燃烧热的热化学方程式是FeS2(S)+
O2 =
Fe2O3(S)+2SO2(g)△H=-853KJ/mol,故答案为:FeS2(S)+
O2 =
Fe2O3(S)+2SO2(g)△H=-853KJ/mol;
(2)萃取、分液的主要仪器为分液漏斗,因为CCl4密度大于水,所以萃取碘后,有机层在下层,水溶液为上层,则后续滴定生成的酸在水溶液中,所以需要取上层水溶液,故答案为:分液漏斗;上;
(3)装置①装有酸性高锰酸钾溶液,具有强氧化性,可氧化除去空气中的还原性气体,提高实验的准确率,故答案为:除去空气中的还原性气体,提高实验的准确率;
(4)根据题意,用氢氧化钠滴定混合强酸溶液,所以常用的指示剂为酚酞,故答案为:酚酞;
(5)对于多次测量数据一般要求平均值进行数据处理,由于第一次所消耗标准液的体积与后两次相关较大,为减小误差,只求后两次标准液的体积的平均值:20.00ml,根据反应4FeS2+11O2=2Fe2O3+8SO2,I2+SO2+2H2O=2HI+H2SO4,H++OH-═H2O,得关系式S~SO2~4H+~4OH-,所以样品中硫元素的质量为:
mol×32g/mol×
=0.48g,所以样品中硫元素的质量分数为
×100%=24.0%,故答案为:24.0%;
(6)装置⑤所得溶液为HI、H2SO4的混合溶液,为测得硫的质量分数,最好选用能与SO42-反应生成不溶于酸性溶液的沉淀,即氯化钡符合题意,故选:B;
| 11 |
| 4 |
| 1 |
| 2 |
| 11 |
| 4 |
| 1 |
| 2 |
(2)萃取、分液的主要仪器为分液漏斗,因为CCl4密度大于水,所以萃取碘后,有机层在下层,水溶液为上层,则后续滴定生成的酸在水溶液中,所以需要取上层水溶液,故答案为:分液漏斗;上;
(3)装置①装有酸性高锰酸钾溶液,具有强氧化性,可氧化除去空气中的还原性气体,提高实验的准确率,故答案为:除去空气中的还原性气体,提高实验的准确率;
(4)根据题意,用氢氧化钠滴定混合强酸溶液,所以常用的指示剂为酚酞,故答案为:酚酞;
(5)对于多次测量数据一般要求平均值进行数据处理,由于第一次所消耗标准液的体积与后两次相关较大,为减小误差,只求后两次标准液的体积的平均值:20.00ml,根据反应4FeS2+11O2=2Fe2O3+8SO2,I2+SO2+2H2O=2HI+H2SO4,H++OH-═H2O,得关系式S~SO2~4H+~4OH-,所以样品中硫元素的质量为:
| 0.020×0.20 |
| 4 |
| 300ml |
| 20ml |
| 0.48 |
| 2.0 |
(6)装置⑤所得溶液为HI、H2SO4的混合溶液,为测得硫的质量分数,最好选用能与SO42-反应生成不溶于酸性溶液的沉淀,即氯化钡符合题意,故选:B;
点评:本题考查了利用二氧化硫的性质测定黄铁矿中硫的质量分数,涉及热化学方程式的书写、滴定实验指示剂的选择以及计算等,考查知识点较多,难度中等.

练习册系列答案
相关题目
下列说法中,正确的是( )
| A、CO2的摩尔质量为44g |
| B、标准状况下,1molCO2所占的体积约是22.4L |
| C、1molN2的质量是14g |
| D、将40gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为1mol/L |
1911年,根据粒子射线实验的基本事实,提出了原子结构的行星模型的伟大科学家是( )
| A、门捷列夫 | B、道尔顿 |
| C、卢瑟福 | D、汤姆孙 |
 某校化学兴趣小组对一款锌铁合金中铁的含量进行测定,该小组提出用测定产生氢气的体积的方法来进行实验.实验过程中需要读取氢气体积.
某校化学兴趣小组对一款锌铁合金中铁的含量进行测定,该小组提出用测定产生氢气的体积的方法来进行实验.实验过程中需要读取氢气体积.