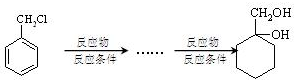
题目内容
1911年,根据粒子射线实验的基本事实,提出了原子结构的行星模型的伟大科学家是( )
| A、门捷列夫 | B、道尔顿 |
| C、卢瑟福 | D、汤姆孙 |
考点:化学史
专题:
分析:A.1869年俄国的科学家门捷列夫发现了元素周期律,并首次编制了元素周期表,使化学学习和研究变得有规律可循;
B.1808年,英国科学家道尔顿提出了原子论.他认为物质都是由原子直接构成的;原子是一个实心球体,不可再分割;
C.1911年英国科学家卢瑟福用一束质量比电子大很多的带正电的高速运动的α粒子轰击金箔,结果是大多数α粒子能穿过金箔且不改变原来的前进方向,但也有一小部分改变了原来的方向,还有极少数的α粒子被反弹了回来.据此他提出了带核的原子结构模型;
D.1897年,英国科学家汤姆逊发现原子中存在电子.1904年汤姆逊提出了一个被称为“西瓜式”结构的原子结构模型,电子就像“西瓜子”一样镶嵌在带正电的“西瓜瓤”中.
B.1808年,英国科学家道尔顿提出了原子论.他认为物质都是由原子直接构成的;原子是一个实心球体,不可再分割;
C.1911年英国科学家卢瑟福用一束质量比电子大很多的带正电的高速运动的α粒子轰击金箔,结果是大多数α粒子能穿过金箔且不改变原来的前进方向,但也有一小部分改变了原来的方向,还有极少数的α粒子被反弹了回来.据此他提出了带核的原子结构模型;
D.1897年,英国科学家汤姆逊发现原子中存在电子.1904年汤姆逊提出了一个被称为“西瓜式”结构的原子结构模型,电子就像“西瓜子”一样镶嵌在带正电的“西瓜瓤”中.
解答:
解:1911年,英国科学家卢瑟福用一束质量比电子大很多的带正电的高速运动的α粒子轰击金箔,结果是大多数α粒子能穿过金箔且不改变原来的前进方向,但也有一小部分改变了原来的方向,还有极少数的α粒子被反弹了回来.据此他提出了带核的原子结构模型.
故选C.
故选C.
点评:本题以原子结构的认识历史为背景,着重考查原子的结构,了解化学发展的历史,理解掌握原子结构的祥细知识,是解题的必要条件,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O反应中,下列说法正确的是( )
| A、Cl2是还原产物 |
| B、HCl全部被还原 |
| C、KMnO4被氧化 |
| D、HCl既表现还原性又表现酸性 |
下列有关离子方程式书写正确的是( )
| A、CaCO3与盐酸反应制CO2:CaCO3+2H+→Ca2++H2O+CO2↑ | ||
B、实验与浓硫酸反应制HCl:H2SO4(浓)+Cl-
| ||
C、电解熔融的氯化钠:2Cl-+2H2O
| ||
| D、Ba(OH)2与小苏打恰好完全反应:Ba2++HCO3-→BaCO3↓+H2O |
判断下列各组微粒的关系为同位素的是( )
| A、H2,D2,T2 |
| B、14C,14N |
| C、35Cl,37 Cl- |
| D、16O,17O,18O |
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,欲除去Cu2+,最好选用下列试剂中的( )
| A、NaOH |
| B、Zn |
| C、Fe |
| D、NH3?H2O |
右图是用0.1000mol/L的NaOH溶液滴定20.00mL未知浓度盐酸(酚酞作指示剂)的滴定曲线.下列说法正确的是( )
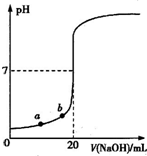

| A、水电离出的氢离子浓度:a>b |
| B、盐酸的物质的量浓度为0.0100mol?L-1 |
| C、指示剂变色时,说明盐酸与NaOH恰好完全反应 |
| D、当滴加NaOH溶液10.00mL时,该混合液的pH=1+lg3 |
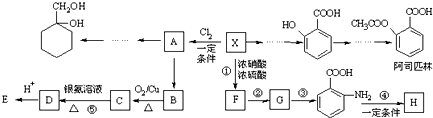
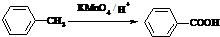
 (苯胺,易被氧化)
(苯胺,易被氧化)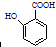 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 和其他无机物合成
和其他无机物合成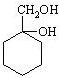 最合理的方案(不超过4步).
最合理的方案(不超过4步).