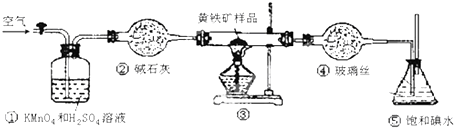
题目内容
 某校化学兴趣小组对一款锌铁合金中铁的含量进行测定,该小组提出用测定产生氢气的体积的方法来进行实验.实验过程中需要读取氢气体积.
某校化学兴趣小组对一款锌铁合金中铁的含量进行测定,该小组提出用测定产生氢气的体积的方法来进行实验.实验过程中需要读取氢气体积.(1)读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是
(2)若称得锌铁合金的质量为0.117g,量气管中初读数为1.00mL,末读数为45.80mL,则合金中铁的含量为
考点:探究物质的组成或测量物质的含量
专题:化学实验与化学计算
分析:(1)由于两者为连通器,所以只要移动水准管的位置,就可以使得两者液面相平;
(2)若称得锌铁合金的质量为0.117g,量气管中初读数为1.00mL,末读数为45.80mL,则生成的氢气体积为44.80ml,物质的量为
=0.002mol,根据合金的质量和氢气总量列方程组求解;
(2)若称得锌铁合金的质量为0.117g,量气管中初读数为1.00mL,末读数为45.80mL,则生成的氢气体积为44.80ml,物质的量为
| 44.80×10 -3L |
| 22.4L/mol |
解答:
解:(1)由于两者为连通器,所以只要移动水准管的位置,就可以使得两者液面相平,故答案为:移动水准管的位置,使水准管、量气管内液面相平;
(2)若称得锌铁合金的质量为0.117g,量气管中初读数为1.00mL,末读数为45.80mL,则生成的氢气体积为44.80ml,物质的量为
=0.002mol,根据合金的质量和氢气总量列方程组,设铁物质的量为xmol,锌的物质的量为ymol,所以有
,解得x=
,y=
,所以合金中铁的含量为
×100%=69.14%,故答案为:69.14;
(2)若称得锌铁合金的质量为0.117g,量气管中初读数为1.00mL,末读数为45.80mL,则生成的氢气体积为44.80ml,物质的量为
| 44.80×10 -3L |
| 22.4L/mol |
|
| 0.013 |
| 9 |
| 0.005 |
| 9 |
56×
| ||
| 0.117 |
点评:本题难度不大,掌握方程式计算即可正确解题,理解连通器的原理是本题测定氢气体积的关键;

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
一个电池反应的离子方程式是 Zn+Cu2+═Zn2++Cu,该反应的原电池正确组合是( )
| A | B | C | D | |
| 正极 | Zn | Cu | Cu | Fe |
| 负极 | Cu | Zn | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | HCl |
| A、A | B、B | C、C | D、D |
下列有关离子方程式书写正确的是( )
| A、CaCO3与盐酸反应制CO2:CaCO3+2H+→Ca2++H2O+CO2↑ | ||
B、实验与浓硫酸反应制HCl:H2SO4(浓)+Cl-
| ||
C、电解熔融的氯化钠:2Cl-+2H2O
| ||
| D、Ba(OH)2与小苏打恰好完全反应:Ba2++HCO3-→BaCO3↓+H2O |
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,欲除去Cu2+,最好选用下列试剂中的( )
| A、NaOH |
| B、Zn |
| C、Fe |
| D、NH3?H2O |
用已知浓度的NaOH溶液滴定未知浓度的盐酸溶液,下列操作会使测定结果偏低的是( )
| A、滴定前对碱式滴定管仰视读数,滴定后又俯视 |
| B、滴定前锥形瓶内含有少量水 |
| C、滴定前,碱式滴定管尖嘴部分有气泡,滴定后气泡消失 |
| D、碱式滴定管用蒸馏水洗净后,直接装入已知浓度的NaOH溶液 |
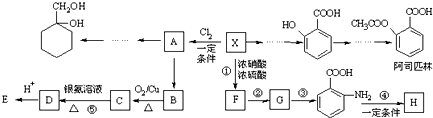
 (苯胺,易被氧化)
(苯胺,易被氧化) 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 和其他无机物合成
和其他无机物合成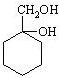 最合理的方案(不超过4步).
最合理的方案(不超过4步).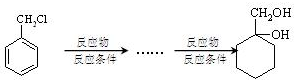
 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,ClO2是一种黄绿色的有毒气体,易溶于水.
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,ClO2是一种黄绿色的有毒气体,易溶于水.