题目内容
为了测定混有少量KCl杂质的硫酸亚铁铵[(NH4)2SO4?FeSO4?nH2O]的纯度,同时测定n的值,按下列流程进行实验: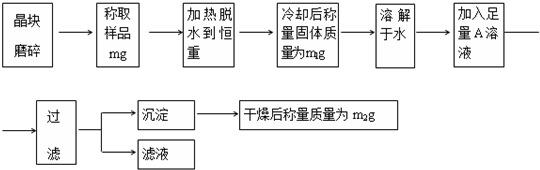
(1)若加热后在空气中冷却称量,则会使测得的n值 .(填“偏大”、“偏小”或“无影响”)
(2)判断已脱水至恒重的方法是 ;
(3)通过实验,测得硫酸亚铁铵化学式中n值为6,则硫酸亚铁铵晶体的纯度为 ;
(4)如何检验硫酸亚铁铵晶体中的Fe2+和NH4+,简述操作步骤:
①Fe2+: .
②NH4+: .

(1)若加热后在空气中冷却称量,则会使测得的n值
(2)判断已脱水至恒重的方法是
(3)通过实验,测得硫酸亚铁铵化学式中n值为6,则硫酸亚铁铵晶体的纯度为
(4)如何检验硫酸亚铁铵晶体中的Fe2+和NH4+,简述操作步骤:
①Fe2+:
②NH4+:
考点:探究物质的组成或测量物质的含量,铵离子检验,二价Fe离子和三价Fe离子的检验
专题:实验探究和数据处理题
分析:(1)若加热后在空气中冷却称量,加热后产物吸水,n值偏小;
(2)当两次称量的质量差不超过0.1g时,可认为加热至恒重,完全脱水;
(3)根据关系式法分析;
(4)①检滴加KSCCN溶液、少量氯水,检验Fe2+;
②根据加碱,铵盐生成氨气进行检验.
(2)当两次称量的质量差不超过0.1g时,可认为加热至恒重,完全脱水;
(3)根据关系式法分析;
(4)①检滴加KSCCN溶液、少量氯水,检验Fe2+;
②根据加碱,铵盐生成氨气进行检验.
解答:
解:(1)若加热后在空气中冷却称量,加热后产物吸水,n值偏小;故答案为:偏小;
(2)当两次称量的质量差不超过0.1g时,可认为加热至恒重,完全脱水;
故答案为:连续两次称量质量差不超过0.1g;
(3)通过实验,测得硫酸亚铁铵化学式中n值为6,干燥后生成硫酸钡的质量为m2g,则硫酸钡的物质的量为
mol,则(NH4)2SO4?FeSO4?nH2O的质量为
mol×
×392g/moL=
g,所以硫酸亚铁铵的纯度为
×100%=
;
,
故答案为:
;
(4)①检验Fe2+,取少量晶体于试管中加水溶解,滴加KSCCN溶液,无明显现象,再滴加少量氯水,溶液呈血红色,证明晶体中有Fe2+,
故答案为:取少量晶体于试管中加水溶解,滴加KSCCN溶液,无明显现象,再滴加少量氯水,溶液呈血红色,证明晶体中有Fe2+;
②检验NH4+,取少量晶体于试管中加水溶解,滴加NaOH溶液,加热,如果产生有刺激性气味且能使湿润的红色石蕊试纸变蓝的气体,证明晶体中有
.
故答案为:取少量晶体于试管中加水溶解,滴加NaOH溶液,加热,如果产生有刺激性气味且能使湿润的红色石蕊试纸变蓝的气体,证明晶体中有
.
(2)当两次称量的质量差不超过0.1g时,可认为加热至恒重,完全脱水;
故答案为:连续两次称量质量差不超过0.1g;
(3)通过实验,测得硫酸亚铁铵化学式中n值为6,干燥后生成硫酸钡的质量为m2g,则硫酸钡的物质的量为
| m2 |
| 233 |
| m2 |
| 233 |
| 1 |
| 2 |
| 196m2 |
| 233 |
| ||
| m |
| 196m2 |
| 233m |
,
故答案为:
| 196m2 |
| 233m |
(4)①检验Fe2+,取少量晶体于试管中加水溶解,滴加KSCCN溶液,无明显现象,再滴加少量氯水,溶液呈血红色,证明晶体中有Fe2+,
故答案为:取少量晶体于试管中加水溶解,滴加KSCCN溶液,无明显现象,再滴加少量氯水,溶液呈血红色,证明晶体中有Fe2+;
②检验NH4+,取少量晶体于试管中加水溶解,滴加NaOH溶液,加热,如果产生有刺激性气味且能使湿润的红色石蕊试纸变蓝的气体,证明晶体中有
| NH | + 4 |
故答案为:取少量晶体于试管中加水溶解,滴加NaOH溶液,加热,如果产生有刺激性气味且能使湿润的红色石蕊试纸变蓝的气体,证明晶体中有
| NH | + 4 |
点评:本题考查物质的组成和含量的测定,题目较难,本题注意实验的原理和操作方法的注意事项,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
下列电子排布图能表示氮原子的最低能量状态的是( )
A、 |
B、 |
C、 |
D、 |
判断下列各组微粒的关系为同位素的是( )
| A、H2,D2,T2 |
| B、14C,14N |
| C、35Cl,37 Cl- |
| D、16O,17O,18O |
用标准盐酸滴定未知浓度的NaOH溶液,如果测得结果偏低,则产生误差的原因可能是下列叙述中的( )
| A、滴定过程中,锥形瓶中有溶液溅出 |
| B、锥形瓶用蒸馏水洗净后,未经干燥即进行滴定 |
| C、酸式滴定管未用标准盐酸润洗 |
| D、滴定前酸式滴定管尖嘴部分有气泡,滴定终止时气泡消失 |
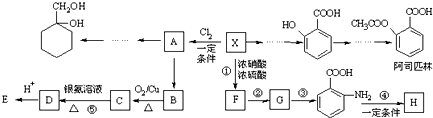
 (苯胺,易被氧化)
(苯胺,易被氧化) 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 和其他无机物合成
和其他无机物合成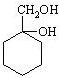 最合理的方案(不超过4步).
最合理的方案(不超过4步).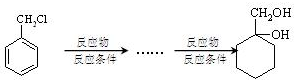

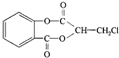 )在一定条件下可以发生如图所示的转化(其他产物和水已略去).
)在一定条件下可以发生如图所示的转化(其他产物和水已略去).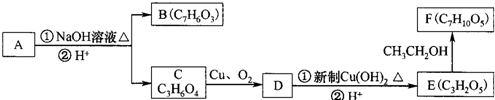
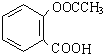 (即乙酰水杨酸,分子式 C9H8O4),满足以下条件的阿司匹林的同分异构体有
(即乙酰水杨酸,分子式 C9H8O4),满足以下条件的阿司匹林的同分异构体有 )经过几步有机反应制得,试写出以乳酸为主要原料制备有机物C的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH
)经过几步有机反应制得,试写出以乳酸为主要原料制备有机物C的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH