题目内容
16.回答下列问题:(1)有一种酸性溶液,含有Na+、SO42-和Cl-,测得三种离子的浓度分别是0.01mol•L-1、0.0035mol•L-1和0.004mol•L-1,该溶液的pH为3.
(2)AlCl3溶液显酸性,试用离子方程式表示这一原理Al3++3H2O?Al(OH)3+3H+.
(3)液氨的电离类似于水,试写出液氨的电离方程式2NH3?NH4++NH2-;在液氨中加入NH4Cl,平衡将向逆反应方向移动.
(4)写出3,5-二甲基-3-庚烯的结构简式CH3-CH2-(CH3)C=CH-CH(CH3)-CH2-CH3.
分析 (1)Na+、SO42-和Cl-三种离子的浓度分别是0.01mol•L-1、0.003 5mol•L-1、0.004mol•L-1,溶液中的阴离子所带负电荷的浓度大于阳离子所带正电荷的浓度,故溶液中应含大量氢离子,即溶液显酸性,根据c(H+)+c(Na+)=2c(SO42-)+c(Cl-)带入数据计算出氢离子浓度,再根据pH=-lgc(H+)计算出该溶液的pH;
(2)铝离子发生水解,溶液显示酸性;
(3)根据水的电离和题给信息结合外界条件对平衡移动的影响分析;
(4)主链上有7个碳原子的烯烃,3号、5号碳原子上有两个甲基,3号碳上有双键.
解答 解:(1)任何溶液中均满足电荷守恒,由于测得Na+、SO42-和Cl-三种离子的浓度分别是0.01mol•L-1、0.003 5mol•L-1、0.004mol•L-1,溶液中的阴离子所带负电荷的浓度大于阳离子所带正电荷的浓度,故溶液中应含大量氢离子,即溶液显酸性,
根据电荷守恒c(H+)+c(Na+)=2c(SO42-)+c(Cl-)可知溶液中氢离子浓度为:c(H+)=0.0035mol/L×2+0.004mol/L-0.01mol/L=0.001mol/L,
该溶液的pH=-lgc(H+)=3,
故答案为:3.
(2)AlCl3溶液中铝离子部分水解,显酸性,水解离子反应为:Al3++3H2O?Al(OH)3+3H+,
故答案为:Al3++3H2O?Al(OH)3+3H+;
(3)液氨类似于水的电离,已知水的电离方程式可写为2H2O?H3O++OH-,则液氨的电离方程式为2NH3?NH4++NH2-,在液氨中加入NH4Cl,NH4+浓度增大,则平衡向逆反应方向移动,
故答案为:2NH3?NH4++NH2-;逆反应方向;
(4)3,5-二甲基-3-庚烯,主链上有7个碳原子,3号、5号碳原子上有两个甲基,3号碳上有双键,结构简式为:CH3-CH2-(CH3)C=CH-CH(CH3)-CH2-CH3,
故答案为:CH3-CH2-(CH3)C=CH-CH(CH3)-CH2-CH3.
点评 本题考查较为综合,涉及弱电解质的电离平衡及其、溶液pH的计算、有机物命名、盐的水解原理等知识,题目难度中等,注意掌握盐的水解原理、弱电解质的电离平衡及其影响,明确有机物命名原则,试题培养了学生的灵活应用能力.

 天天练口算系列答案
天天练口算系列答案| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑤ | ⑦ | ⑨ | |||||
| 第3周期 | ① | ③ | ⑥ | ④ | ⑧ | ⑩ | ||
| 第4周期 | ② |
(2)元素最高价氧化物对应的水化物中,碱性最强的是KOH,该化合物与③的最高价氧化物的水化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(3)⑥、⑦、④三种元素形成气态氢化物的还原性由大到小的顺序是PH3>H2S>H2O.
(4)⑤、⑧的氢化物相互反应,产生白色固体,对该固体中阳离子存在检验的操作方法及现象是:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生).
(5)两种均含①④⑦和氢元素四种元素的化合物相互反应的化学方程式为NaHSO3+NaHSO4=Na2SO4+SO2↑+H2O.
(6)元素⑤的最高价含氧酸,与76.8mg的Cu反应,Cu完全溶解,酸根离子减少了2.2×10-3mol,则H+的变化情况是减少(增加、减少、不变)4.6×10-3mol.
| A. | 将食物置于冰箱中冷藏保存 | B. | 将FeCl3加入H2O2溶液中制备O2 | ||
| C. | 将洗衣粉溶于温水后洗涤衣服 | D. | 将CaCO3固体研磨后再与稀HCl反应 |
| A. | 丙烷 | B. | 新戊烷 | C. | 正丁烷 | D. | 异丁烷 |
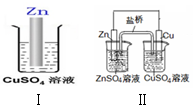
| A. | Ⅱ中盐桥中的Cl-移向ZnSO4溶液 | |
| B. | Ⅰ、Ⅱ的反应原理均是Zn+Cu2+=Zn2++Cu | |
| C. | Ⅰ、Ⅱ中均有电子转移,均是把化学能转化成电能利用 | |
| D. | 随着反应的进行,Ⅰ、Ⅱ中CuSO4溶液颜色均渐渐变浅 |
| A. | Q1=Q | B. | Q1>Q | C. | Q1<Q | D. | 无法判断 |
 原子序数小于36的X、Y、Z、W四种元素,其中X是宇宙中最丰富的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.
原子序数小于36的X、Y、Z、W四种元素,其中X是宇宙中最丰富的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.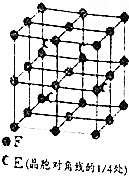 A、B、C、D、E、F为元素周期表前四周期元素且原子序数依次增大,A的基态原子有3个不同的能级,各能级中电子数相等;B2-、C-、D+、E3+具有相同的电子构型;D元素的焰色反应呈黄色;F的基态原子的价电子排布式为3d64s2.
A、B、C、D、E、F为元素周期表前四周期元素且原子序数依次增大,A的基态原子有3个不同的能级,各能级中电子数相等;B2-、C-、D+、E3+具有相同的电子构型;D元素的焰色反应呈黄色;F的基态原子的价电子排布式为3d64s2. .
.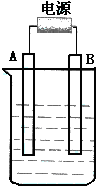 如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g,请回答下列问题:
如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g,请回答下列问题: