题目内容
5.已知可逆反应2SO2+O2?2SO3,当生成2mol SO3时放出热量为Q,现将2mol SO2和1mol O2在相同条件下反应生成SO3,放出的热量为Q1,则( )| A. | Q1=Q | B. | Q1>Q | C. | Q1<Q | D. | 无法判断 |
分析 二氧化硫与氧气的反应为可逆反应,则2mol SO2和1molO2反应生成的三氧化硫的物质的量小于2mol,放热的热量一定小于Q,据此进行解答.
解答 解:将2mol SO2和1mol O2在相同条件下反应生成SO3,由于该反应为可逆反应,则反应生成的三氧化硫的物质的量小于2mol,放出的热量一定小于Q,即:Q1<Q,
故选C.
点评 本题考查了放热的比较、可逆反应特点,题目难度不大,明确可逆反应特点为解答关键,注意掌握化学反应与能力变化的关系,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
15.具有9个质子和10个电子的微粒是( )
| A. | Na+ | B. | O2- | C. | F- | D. | Ne |
13.工业上电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )

| A. | a极与电源的负极相连 | |
| B. | 产物丙为硫酸溶液 | |
| C. | 离子交换膜d为阴离子交换膜 | |
| D. | 每转移0.1mol e-则产生1.12L气体乙 |
20.氮化铝具有耐高温、抗冲击、导热性好等优良性能,在电子工业、陶瓷工业等领域有广泛应用.其合成反应为:Al2O3+N2+3C=2AlN+3CO,下列说法不正确的是( )
| A. | C作还原剂,在反应中被氧化 | |
| B. | 每转移2mol e-时,可产生1mol CO | |
| C. | N2作氧化剂,AlN是还原产物 | |
| D. | 欲制得2molAlN,实际消耗N2体积大于22.4L |
10.一种熔融碳酸盐燃料电池原理示意如图.

下列有关该电池的说法不正确的是( )

下列有关该电池的说法不正确的是( )
| A. | 电极A上H2参与的电极反应为:CO+H2+2CO32--4e-=3CO2+H2O | |
| B. | 理论上,A极每消耗1molH2,则消耗$\frac{1}{3}$molCH4 | |
| C. | 电池工作时,CO32-向电极A移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
17.已知咖啡酸的结构如图所示.关于咖啡酸的描述正确的是( )
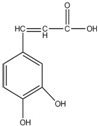

| A. | 该有机物属于烃类 | |
| B. | 与溴水既能发生取代反应,又能发生加成反应 | |
| C. | 1mol咖啡酸最多可与5mol氢气发生加成反应 | |
| D. | 能与Na2CO3溶液反应,但不能与NaHCO3溶液反应 |
14.化学在生产和日常生活中有着重要的应用,下列说法不正确的是( )
| A. | 钠的金属活动性排在铜前面,所以金属钠可以置换出硫酸铜溶液中的铜 | |
| B. | 铁制容器盛放和运输浓硫酸 | |
| C. | 明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物.可用于水的净化 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
15. 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
(1)已知25℃时,①HF(aq)+OH-(aq)═F-(aq)+H2O(l)△H=-67.7 kJ/mol,
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,
氢氟酸的电离方程式及热效应可表示为HF(aq)?H+(aq)+F-(aq)△H=-10.4kJ•mol-1.
(2)将浓度为0.1 mol/L HF溶液加水稀释一倍(假设温度不变),下列各量增大的是CD.
A.c(H+) B.c(H+)•c(OH-)
C.$\frac{c({H}^{+})}{c({H}^{-})}$ D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
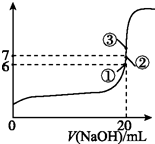
(3)在20 mL 0.1 mol/L氢氟酸中加入V mL 0.1 mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是BC.
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20 mL,此时溶液中c(F-)<c(Na+)=0.1 mol/L
(4)物质的量浓度均为0.1 mol/L的下列四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③NaF溶液④NaClO溶液.依据数据判断pH由大到小的顺序是①>④>②>③.
(5)Na2CO3溶液显碱性是因为CO${\;}_{3}^{2-}$水解的缘故,请设计简单的实验事实证明之在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅.
(6)长期以来,一直认为氟的含氧酸不存在.1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F.HFO与水反应得到HF和化合物A,每生成1 mol HF转移1mol电子.
 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数(Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,
氢氟酸的电离方程式及热效应可表示为HF(aq)?H+(aq)+F-(aq)△H=-10.4kJ•mol-1.
(2)将浓度为0.1 mol/L HF溶液加水稀释一倍(假设温度不变),下列各量增大的是CD.
A.c(H+) B.c(H+)•c(OH-)
C.$\frac{c({H}^{+})}{c({H}^{-})}$ D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(3)在20 mL 0.1 mol/L氢氟酸中加入V mL 0.1 mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是BC.
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20 mL,此时溶液中c(F-)<c(Na+)=0.1 mol/L
(4)物质的量浓度均为0.1 mol/L的下列四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③NaF溶液④NaClO溶液.依据数据判断pH由大到小的顺序是①>④>②>③.
(5)Na2CO3溶液显碱性是因为CO${\;}_{3}^{2-}$水解的缘故,请设计简单的实验事实证明之在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅.
(6)长期以来,一直认为氟的含氧酸不存在.1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F.HFO与水反应得到HF和化合物A,每生成1 mol HF转移1mol电子.