题目内容
8.综合如图判断,下列叙述不正确的是(Ⅱ中盐桥为KCl溶液)( )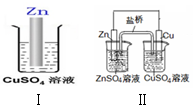
| A. | Ⅱ中盐桥中的Cl-移向ZnSO4溶液 | |
| B. | Ⅰ、Ⅱ的反应原理均是Zn+Cu2+=Zn2++Cu | |
| C. | Ⅰ、Ⅱ中均有电子转移,均是把化学能转化成电能利用 | |
| D. | 随着反应的进行,Ⅰ、Ⅱ中CuSO4溶液颜色均渐渐变浅 |
分析 A.II中阴离子向负极移动;
B.Ⅰ、Ⅱ的反应均为Zn与铜离子的氧化还原反应;
C.I中Zn与铜离子直接接触发生置换反应;
D.铜离子被消耗,铜离子浓度减小.
解答 解;A.II中阴离子向负极移动,Zn失电子为负极,所以盐桥中的Cl-移向ZnSO4溶液,故A正确;
B.Ⅰ、Ⅱ的反应均为Zn与铜离子的氧化还原反应,其反应方程式为:Zn+Cu2+=Zn2++Cu,故B正确;
C.I中Zn与铜离子直接接触发生置换反应,不满足原电池的条件,不能把化学能转化为电能,故C错误;
D.铜离子被消耗,铜离子浓度减小,所以,Ⅰ、Ⅱ中CuSO4溶液颜色均渐渐变浅,故D正确.
故选C.
点评 本题考查了原电池原理的应用、Zn与铜离子的置换反应等,注意把握原电池中离子的移动方向,题目难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
3.浓度均为0.1mol/L的下列溶液中:①盐酸 ②硫酸 ③氢氧化钠 ④醋酸,pH值由小到大的顺序( )
| A. | ①②④③ | B. | ③④②① | C. | ②①④③ | D. | ④②①③ |
13.工业上电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是( )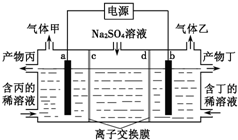

| A. | a极与电源的负极相连 | |
| B. | 产物丙为硫酸溶液 | |
| C. | 离子交换膜d为阴离子交换膜 | |
| D. | 每转移0.1mol e-则产生1.12L气体乙 |
20.氮化铝具有耐高温、抗冲击、导热性好等优良性能,在电子工业、陶瓷工业等领域有广泛应用.其合成反应为:Al2O3+N2+3C=2AlN+3CO,下列说法不正确的是( )
| A. | C作还原剂,在反应中被氧化 | |
| B. | 每转移2mol e-时,可产生1mol CO | |
| C. | N2作氧化剂,AlN是还原产物 | |
| D. | 欲制得2molAlN,实际消耗N2体积大于22.4L |
17.已知咖啡酸的结构如图所示.关于咖啡酸的描述正确的是( )
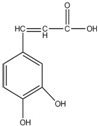

| A. | 该有机物属于烃类 | |
| B. | 与溴水既能发生取代反应,又能发生加成反应 | |
| C. | 1mol咖啡酸最多可与5mol氢气发生加成反应 | |
| D. | 能与Na2CO3溶液反应,但不能与NaHCO3溶液反应 |
18.能正确表示下列反应的离子方程式为( )
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 用催化法处理汽车尾气中的CO和NO:CO+NO$\stackrel{催化剂}{→}$C+NO2 | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
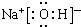 .AB-离子的电子式为
.AB-离子的电子式为 .
.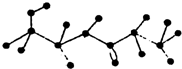 某有机物含有C、H、O、N四种元素,图为该有机物的球棍模型.
某有机物含有C、H、O、N四种元素,图为该有机物的球棍模型.