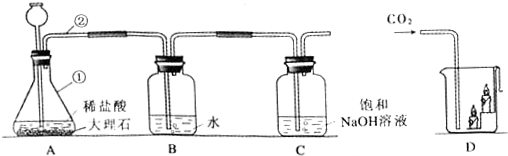
题目内容
3.连二亚硫酸钠(Na2S2O4)是印刷工业中重要的还原剂.某小组进行如下实验:已知:
①、连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.
②、4HCl+2Na2S2O4=4NaCl+S↓+3SO2↑+2H2O
I.制备
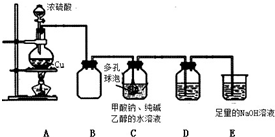
75℃时,将甲酸钠和纯碱加入乙醇水溶液溶解后,再加入装置 C 中,然后通入 SO2 进 行反应,其反应方程式为:2HCOONa+Na2CO3+4SO2=2Na2S2O4+3CO2+H2O.
分析并回答下列问题:
(1)A 中反应的化学方程式为Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;冷却至 40~50℃,过 滤,用乙醇洗涤,干燥制得 Na2S2O4.
(2)C 中多孔球泡的作用是 增大接触面积,促进SO2的吸收
(3)装置 D 盛放品红溶液,作用是检验装置 C 中 SO2 的吸收效率,若在吸收过程中 D
中颜色逐渐褪去,此时应该采取的措施是撤去A中酒精灯,减缓SO2的生成速率
II.【Na2S2O4 的性质】
取纯净的 Na2S2O4 晶体,配成溶液,进行下列性质探究实验,完成表的空格
(供选择的试剂:淀粉-KI 溶液、紫色石蕊试液、稀硝酸、BaCl2 溶液)
| 假 设 | 操作 | 现 象 | 原理 |
| Na2S2O4 为强 碱弱酸盐,其溶 液为碱性. | 取少量溶液于试管中,滴加 紫色石蕊试液 | 溶液变 成蓝色 | S2O42-水解,使溶液成碱性 |
| Na2S2O4 中 S 为 +3 价,具有较强 的还原性. | 取少量溶液于试管中,滴加过量新制氯水,再 滴加 BaCl2 溶液 | 有白色沉淀生 成 | 该反应的离子方程式依次为: 4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+ Ba2++SO42-=BaSO4↓ |
取 8.00g 制备的晶体溶解后,加入足量稀硫酸,充分反应后,过滤、洗涤、干燥.得固 体 0.64g.则 Na2S2O4的纯度为87%[已知:M(Na2S2O4)=174.0].
分析 (1)A 中反应即铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,据此书写;连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇,因此可以用乙醇洗涤产品;
(2)C 中多孔球泡的作用是增大接触面积,促进SO2的吸收;
(3)根据吸收过程中 D中颜色逐渐褪去,说明二氧化硫吸收效率低,应减慢生成二氧化硫的速率;
II.【Na2S2O4 的性质】根据碱遇紫色石蕊试液变成蓝色,滴加过量新制氯水,再滴加 BaCl2溶液有白色沉淀生成,说明生成硫酸根,据此分析;
III.【测定 Na2S2O4的纯度】根据4HCl+2Na2S2O4=4NaCl+S↓+3SO2↑+2H2O,所以取 8.00g 制备的晶体溶解后,加入足量稀硫酸,充分反应后,过滤、洗涤、干燥得固 体 0.64g即为S单质质量,据此计算.
解答 解:(1)A 中反应即铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,则化学方程式为:Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
连二亚硫酸钠易溶于水,难溶于乙醇,因此可以用乙醇洗涤产品,减少因溶解导致的损失,
故答案为:Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;乙醇;
(2)C 中多孔球泡的作用是增大接触面积,促进SO2的吸收,故答案为:增大接触面积,促进SO2的吸收;
(3)因为吸收过程中 D中颜色逐渐褪去,说明二氧化硫吸收效率低,应减慢生成二氧化硫的速率,所以此时应该采取的措施是撤去A中酒精灯,减缓SO2的生成速率;故答案为:撤去A中酒精灯,减缓SO2的生成速率;
II.【Na2S2O4 的性质】因为碱遇紫色石蕊试液变成蓝色,所以取少量溶液于试管中,应滴加紫色石蕊试液;因为滴加过量新制氯水,再滴加 BaCl2溶液有白色沉淀生成,说明新制氯水将Na2S2O4 中 S 氧化生成硫酸根,硫酸根再与钡离子反应生成白色硫酸钡沉淀,离子方程式为:4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+
,Ba2++SO42-=BaSO4↓;
故答案为:
| 假设 | 操作 | 现象 | 原理 |
| 紫色石蕊试液 | |||
| 4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+ Ba2++SO42-=BaSO4↓ |
点评 本题考查物质制备和检验、实验设计与探究等,是对学生综合能力的考查,为高考常考题型,注意对题目信息的应用,难度中等.

| 选项 | a | b | 现象 | 离子方程式 |
| A | 稀硫酸 | KI | 在空气中放置一段时间后溶液呈棕黄色 | 4I-+O2+2H2O=2I2+4OH- |
| B | Na2CO3 | 稀盐酸 | 开始时无气泡,后来有气泡 | CO32-+H+=HCO3-;HCO3-+H+=H2O+CO2↑ |
| C | 稀盐酸 | Na2SiO3 | 产生白色胶状物 | 2H++SiO32-=H2SiO3(胶体) |
| D | 稀H2SO4 | 滴有酚酞的Ba(OH)2 | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
| A. | 分子式C7H16的烃,分子中有4个甲基的同分异构体有4种(不考虑立体异构) | |
| B. |  的名称为:2,2,4-三甲基-4-戊烯 的名称为:2,2,4-三甲基-4-戊烯 | |
| C. | 化合物  是苯的同系物 是苯的同系物 | |
| D. | 植物油的主要成分是不饱和高级脂肪酸 |
| A. | 在氯化铝溶液中滴加氨水 | B. | 在偏铝酸钠溶液中通入CO2 | ||
| C. | 在氯化铝溶液中滴加氢氧化钠溶液 | D. | 在硫酸铝溶液中滴加偏铝酸钠溶液 |
 如图是同学们经常使用的某品牌修正液包装标签.小明仔细阅读后,结合自己的生活经验和所学知识得出了修正液的某些性质,小明的推测中不合理的是( )
如图是同学们经常使用的某品牌修正液包装标签.小明仔细阅读后,结合自己的生活经验和所学知识得出了修正液的某些性质,小明的推测中不合理的是( )| A. | 修正液是一种胶体,均一、稳定 | B. | 修正液中含有有毒的化学物质 | ||
| C. | 修正液的成分对纸张不具腐蚀性 | D. | 修正液的溶剂易挥发、易燃 |
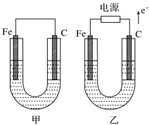 如图所示,甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题.
如图所示,甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题.