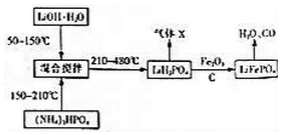
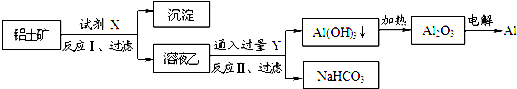
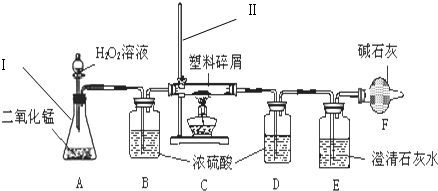
题目内容
14.将少量的a溶液加入到b溶液中,现象及对应的离子方程式正确的是( )| 选项 | a | b | 现象 | 离子方程式 |
| A | 稀硫酸 | KI | 在空气中放置一段时间后溶液呈棕黄色 | 4I-+O2+2H2O=2I2+4OH- |
| B | Na2CO3 | 稀盐酸 | 开始时无气泡,后来有气泡 | CO32-+H+=HCO3-;HCO3-+H+=H2O+CO2↑ |
| C | 稀盐酸 | Na2SiO3 | 产生白色胶状物 | 2H++SiO32-=H2SiO3(胶体) |
| D | 稀H2SO4 | 滴有酚酞的Ba(OH)2 | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
分析 A.离子方程式错误,酸性条件下,反应产物中不能存在氢氧根离子;
B.碳酸钠加入稀盐酸中,开始就生成气体,现象和离子方程式都错误;
C.硅酸钠与稀盐酸反应生成硅酸胶体;
D.离子方程式错误,氢离子、氢氧根离子的计量数与硫酸、氢氧化钡的化学式书写.
解答 解:A.稀硫酸滴入碘化钾溶液,在空气中放置一段时间后碘离子被氧化成碘单质,溶液呈棕黄色,正确的离子方程式为:4I-+O2+4H+=2I2+2H2O,题中离子方程式不合理,故A错误;
B.Na2CO3溶液加入到稀盐酸中,立刻会生成气体,反应的离子方程式为:CO32-+2H+=H2O+CO2↑,题中现象描述和离子方程式都不合理,故B错误;
C.将稀盐酸滴入Na2SiO3溶液中,二者反应生成硅酸胶体和氯化钠,产生白色胶状物,反应的离子方程式为:2H++SiO32-=H2SiO3(胶体),题中现象及对应的离子方程式都正确,故C正确;
D.将稀硫酸滴入滴有酚酞的Ba(OH)2溶液中,有白色沉淀硫酸钡生成,由于氢氧根离子与氢离子反应,则溶液由红色变为无色,反应的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,题中离子方程式不合理,故D错误;
故选C.
点评 本题考查实验方案的评价、离子方程式的正误判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
5.如图,各烧杯中盛有海水,铁在其中被腐蚀的速度由快到慢的顺序为( )
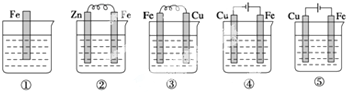

| A. | ①②③④⑤ | B. | ④③②①⑤ | C. | ④③①②⑤ | D. | ④②③①⑤ |
9.萘的结构简式为  ,如果它与溴发生取代反应,试推断生成的一溴取代物最多可能有几种( )
,如果它与溴发生取代反应,试推断生成的一溴取代物最多可能有几种( )
 ,如果它与溴发生取代反应,试推断生成的一溴取代物最多可能有几种( )
,如果它与溴发生取代反应,试推断生成的一溴取代物最多可能有几种( )| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
6.已知氧化性Br2>Fe3+.FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:a Fe2++b Br-+c Cl2→d Fe3++e Br2+f Cl-,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |
3.连二亚硫酸钠(Na2S2O4)是印刷工业中重要的还原剂.某小组进行如下实验:
已知:
①、连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.
②、4HCl+2Na2S2O4=4NaCl+S↓+3SO2↑+2H2O
I.制备
75℃时,将甲酸钠和纯碱加入乙醇水溶液溶解后,再加入装置 C 中,然后通入 SO2 进 行反应,其反应方程式为:2HCOONa+Na2CO3+4SO2=2Na2S2O4+3CO2+H2O.
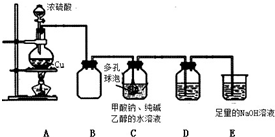
分析并回答下列问题:
(1)A 中反应的化学方程式为Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;冷却至 40~50℃,过 滤,用乙醇洗涤,干燥制得 Na2S2O4.
(2)C 中多孔球泡的作用是 增大接触面积,促进SO2的吸收
(3)装置 D 盛放品红溶液,作用是检验装置 C 中 SO2 的吸收效率,若在吸收过程中 D
中颜色逐渐褪去,此时应该采取的措施是撤去A中酒精灯,减缓SO2的生成速率
II.【Na2S2O4 的性质】
取纯净的 Na2S2O4 晶体,配成溶液,进行下列性质探究实验,完成表的空格
(供选择的试剂:淀粉-KI 溶液、紫色石蕊试液、稀硝酸、BaCl2 溶液)
III.【测定 Na2S2O4的纯度】
取 8.00g 制备的晶体溶解后,加入足量稀硫酸,充分反应后,过滤、洗涤、干燥.得固 体 0.64g.则 Na2S2O4的纯度为87%[已知:M(Na2S2O4)=174.0].
已知:
①、连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.
②、4HCl+2Na2S2O4=4NaCl+S↓+3SO2↑+2H2O
I.制备
75℃时,将甲酸钠和纯碱加入乙醇水溶液溶解后,再加入装置 C 中,然后通入 SO2 进 行反应,其反应方程式为:2HCOONa+Na2CO3+4SO2=2Na2S2O4+3CO2+H2O.

分析并回答下列问题:
(1)A 中反应的化学方程式为Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;冷却至 40~50℃,过 滤,用乙醇洗涤,干燥制得 Na2S2O4.
(2)C 中多孔球泡的作用是 增大接触面积,促进SO2的吸收
(3)装置 D 盛放品红溶液,作用是检验装置 C 中 SO2 的吸收效率,若在吸收过程中 D
中颜色逐渐褪去,此时应该采取的措施是撤去A中酒精灯,减缓SO2的生成速率
II.【Na2S2O4 的性质】
取纯净的 Na2S2O4 晶体,配成溶液,进行下列性质探究实验,完成表的空格
(供选择的试剂:淀粉-KI 溶液、紫色石蕊试液、稀硝酸、BaCl2 溶液)
| 假 设 | 操作 | 现 象 | 原理 |
| Na2S2O4 为强 碱弱酸盐,其溶 液为碱性. | 取少量溶液于试管中,滴加 紫色石蕊试液 | 溶液变 成蓝色 | S2O42-水解,使溶液成碱性 |
| Na2S2O4 中 S 为 +3 价,具有较强 的还原性. | 取少量溶液于试管中,滴加过量新制氯水,再 滴加 BaCl2 溶液 | 有白色沉淀生 成 | 该反应的离子方程式依次为: 4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+ Ba2++SO42-=BaSO4↓ |
取 8.00g 制备的晶体溶解后,加入足量稀硫酸,充分反应后,过滤、洗涤、干燥.得固 体 0.64g.则 Na2S2O4的纯度为87%[已知:M(Na2S2O4)=174.0].
4.下列说法正确的是( )
| A. | 32g O2中含有32NA个电子 | |
| B. | 22.4L N2含有阿伏加德罗常数个氮分子 | |
| C. | 在标准状况下,22.4L水的质量约为18g | |
| D. | 常温常压下22g的CO2与标准状况下11.2L HCl含有相同的分子数 |