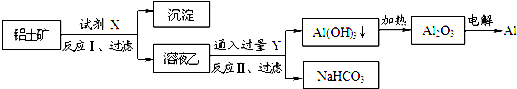
题目内容
11.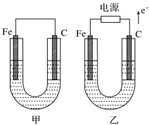 如图所示,甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题.
如图所示,甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题.(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的碳棒,乙池中的铁棒.
②乙池中阳极的电极反应式是:4OH--4e-=O2↑+2H2O.
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-.
②甲池中碳极的电极反应式是:2H2O+O2+4e-═4OH-,乙池中碳极的电极反应属于氧化反应(填“氧化反应”或“还原反应”).
③将湿润的淀粉KI试纸放在乙池中碳极附近,发现试纸变蓝,过一段时间后又发现蓝色褪去,这是因为过量的Cl2又将生成的I2氧化.若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,该反应的化学方程式为:5Cl2+I2+6H2O═2HIO3+10HCl.
分析 (1)甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,阳极上氢氧根离子放电;
(2)①电解NaCl溶液生成NaOH、氢气、氯气;
②甲中碳为正极,氧气得电子生成氢氧根,乙中碳为阳极,发生氧化反应;
③根据得失电子数相等确定生成物,再根据反应物和生成物写出反应方程式.
解答 解:(1)①甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,所以碳电极上生成红色物质Cu,乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,故答案为:碳;铁;
②乙中阳极上氢氧根离子放电,电极反应为4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(2)①电解NaCl溶液生成NaOH、氢气、氯气,离子反应为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;
②甲中碳为正极,氧气得电子生成氢氧根,电极反应为2H2O+O2+4e-═4OH-,乙中碳为阳极,发生氧化反应;
故答案为:2H2O+O2+4e-═4OH-;氧化反应;
③过量的Cl2将生成的I2又氧化,氯气被还原生成氯离子,1mol氯气被还原得到2mol电子,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,根据得失电子数相等知,含碘的酸中碘的化合价是+5价,所以含碘的酸是碘酸,故氯气和碘、水反应生成盐酸和碘酸,反应方程式为:5Cl2+I2+6H2O=2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O=2HIO3+10HCl.
点评 本题考查原电池和电解原理,明确工作原理及发生的电极反应是解答的关键,注意电极的判断和电子守恒的应用,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | SO2 | B. | FeCl2 | C. | MgO | D. | Na2O2 |
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |
已知:
①、连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.
②、4HCl+2Na2S2O4=4NaCl+S↓+3SO2↑+2H2O
I.制备
75℃时,将甲酸钠和纯碱加入乙醇水溶液溶解后,再加入装置 C 中,然后通入 SO2 进 行反应,其反应方程式为:2HCOONa+Na2CO3+4SO2=2Na2S2O4+3CO2+H2O.
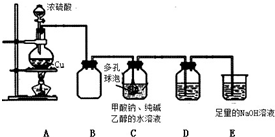
分析并回答下列问题:
(1)A 中反应的化学方程式为Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;冷却至 40~50℃,过 滤,用乙醇洗涤,干燥制得 Na2S2O4.
(2)C 中多孔球泡的作用是 增大接触面积,促进SO2的吸收
(3)装置 D 盛放品红溶液,作用是检验装置 C 中 SO2 的吸收效率,若在吸收过程中 D
中颜色逐渐褪去,此时应该采取的措施是撤去A中酒精灯,减缓SO2的生成速率
II.【Na2S2O4 的性质】
取纯净的 Na2S2O4 晶体,配成溶液,进行下列性质探究实验,完成表的空格
(供选择的试剂:淀粉-KI 溶液、紫色石蕊试液、稀硝酸、BaCl2 溶液)
| 假 设 | 操作 | 现 象 | 原理 |
| Na2S2O4 为强 碱弱酸盐,其溶 液为碱性. | 取少量溶液于试管中,滴加 紫色石蕊试液 | 溶液变 成蓝色 | S2O42-水解,使溶液成碱性 |
| Na2S2O4 中 S 为 +3 价,具有较强 的还原性. | 取少量溶液于试管中,滴加过量新制氯水,再 滴加 BaCl2 溶液 | 有白色沉淀生 成 | 该反应的离子方程式依次为: 4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+ Ba2++SO42-=BaSO4↓ |
取 8.00g 制备的晶体溶解后,加入足量稀硫酸,充分反应后,过滤、洗涤、干燥.得固 体 0.64g.则 Na2S2O4的纯度为87%[已知:M(Na2S2O4)=174.0].
| A. | 11.2L H2中含有的原子数为NA个 | |
| B. | 0.012kgC-14中约含有6.02×1023个碳原子 | |
| C. | 18g H2O中含有电子数为3NA个 | |
| D. | NA个氧气分子和NA个氢气分子的质量比等于16:1 |

| A. | ①中阳极处能产生使湿润淀粉KI试纸变蓝的气体 | |
| B. | ②中待镀铁制品应与电源正极相连 | |
| C. | ③中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法 | |
| D. | ④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |