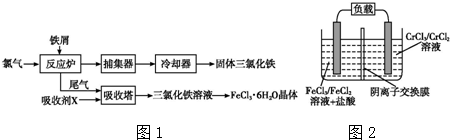
题目内容
13.根据下列热化学方程式:①C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H2=-285.8kJ/mol
③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
| A. | △H=+244.1kJ/mol | B. | △H=-488.3kJ/mol | C. | △H=-996.6kJ/mol | D. | △H=+996.6kJ/mol |
分析 由盖斯定律可知,①×2+②×2-③得到2C(s)+2H2(g)+O2(g)=CH3COOH(l),以此计算反应热.
解答 解:①C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H2=-285.8kJ/mol
③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
由盖斯定律可知,①×2+②×2-③得到2C(s)+2H2(g)+O2(g)=CH3COOH(l),
则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热△H=(-393.5kJ/mol)×2+(-285.8kJ/mol)×2-(-870.3kJ/mol)=-488.3kJ/mol,
故选B.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、已知反应与目标反应的关系为解答的关键,侧重分析与应用能力的考查,注意盖斯定律的应用,题目难度不大.

练习册系列答案
相关题目
4.乙酸丁酯是优良的有机溶剂,因有愉快的果香气味,也用于香料工业.实验室制取乙酸丁酯的有关信息及装置示意图如下:
实验操作流程为:
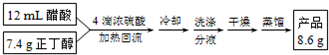
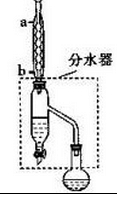
(1)装置a的名称是球形冷凝管,其中冷却水的流动方向是下口进上口出.
(2)制取乙酸丁酯的化学方程式为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O.加热回流时,分水器中液体分为两层,适时放出水使上层液体流入烧瓶b,从平衡角度考虑,分水器的作用是除去酯化反应生成的水,使生成乙酸丁酯的平衡向正反应方向移动.
(3)反应结束后,把分水器中的酯层和b中的反应液一起倒入分液漏斗中.在分液漏斗中加入10 mL水洗涤,除去下层,上层继续用10 mL 10% Na2CO3溶液洗涤至中性,分液后将上层液体再用10 mL水洗涤,除去溶于酯中的少量无机盐.下列说法不正确的是D(填序号).
A.最初用10 mL水洗涤的目的是除去酸及少量的正丁醇
B.用10 mL 10% Na2CO3洗涤的目的是除去残留的硫酸和乙酸
C.分液时先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口到出
D.分液时先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
(4)在洗涤、分液后的乙酸丁酯中加入少量无水硫酸镁,其目的是除去乙酸丁酯中的水(或干燥乙酸丁酯).
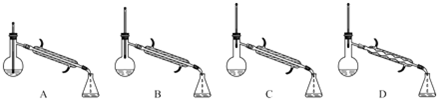
(5)在蒸馏操作中,仪器选择及安装都正确的是C(填标号).
(6)本实验的产率是74%.
| 密度/(g•cm-3) | 沸点/℃ | 水溶性 | |
| 1-丁醇 | 0.81 | 117.7 | 可溶 |
| 乙 酸 | 1.05 | 117.9 | 互溶 |
| 乙酸丁酯 | 0.88 | 126.3 | 微溶 |


(1)装置a的名称是球形冷凝管,其中冷却水的流动方向是下口进上口出.
(2)制取乙酸丁酯的化学方程式为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O.加热回流时,分水器中液体分为两层,适时放出水使上层液体流入烧瓶b,从平衡角度考虑,分水器的作用是除去酯化反应生成的水,使生成乙酸丁酯的平衡向正反应方向移动.
(3)反应结束后,把分水器中的酯层和b中的反应液一起倒入分液漏斗中.在分液漏斗中加入10 mL水洗涤,除去下层,上层继续用10 mL 10% Na2CO3溶液洗涤至中性,分液后将上层液体再用10 mL水洗涤,除去溶于酯中的少量无机盐.下列说法不正确的是D(填序号).
A.最初用10 mL水洗涤的目的是除去酸及少量的正丁醇
B.用10 mL 10% Na2CO3洗涤的目的是除去残留的硫酸和乙酸
C.分液时先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口到出
D.分液时先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
(4)在洗涤、分液后的乙酸丁酯中加入少量无水硫酸镁,其目的是除去乙酸丁酯中的水(或干燥乙酸丁酯).
(5)在蒸馏操作中,仪器选择及安装都正确的是C(填标号).

(6)本实验的产率是74%.
8.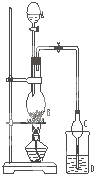 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH ②有关有机物的沸点:
请回答:
(1)浓硫酸的作用:催化剂、吸水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-;反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)该小组同学在实验时才取了加入过量的乙醇,目的是增加乙醇的用量提高乙酸的转化率和提高产率,同时慢慢滴加乙酸并加热蒸馏,蒸馏的目的是蒸馏出乙酸乙酯,减小生成物,反应正向移动,提高产率 .
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇和水;再加入(此空从下列选项中选择)C;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯.
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰.
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH ②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用:催化剂、吸水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-;反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)该小组同学在实验时才取了加入过量的乙醇,目的是增加乙醇的用量提高乙酸的转化率和提高产率,同时慢慢滴加乙酸并加热蒸馏,蒸馏的目的是蒸馏出乙酸乙酯,减小生成物,反应正向移动,提高产率 .
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇和水;再加入(此空从下列选项中选择)C;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯.
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰.
5.下列说法正确的是( )
| A. | 物质发生化学变化不一定伴随着能量变化 | |
| B. | 硫酸钡、醋酸铵、氨水都是弱电解质 | |
| C. | 向0.1 mol•L-1 Na2CO3溶液中滴加酚酞,溶液变红色 | |
| D. | 在温度、压强一定的条件下,自发反应总是向△H-T△S<0的方向进行 |
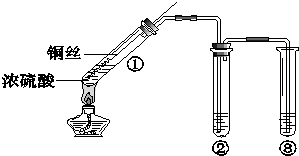 某小组同学探究浓硫酸及其部分反应产物的化学性质,装置如图所示(夹持装置略去).
某小组同学探究浓硫酸及其部分反应产物的化学性质,装置如图所示(夹持装置略去).