题目内容
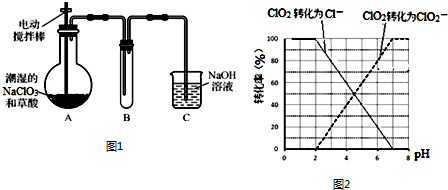
18.亚硝酸钠大量用于染料和有机合成工业.用木屑制备亚硝酸钠的流程如图1:
已知氧化过程中,控制反应液的温度在55~60℃条件下发生的主要反应为:C6H12O6+12HNO3═3H2C2O4+9NO2↑+3NO↑+9H2O
(1)酸溶过程中,硫酸的作用是催化剂或使纤维素水解成为葡萄糖.吸收完成后,将吸收液蒸发浓缩、冷却结晶、过滤、洗涤得到白色晶状的亚硝酸钠.
(2)实验室模拟氧化和吸收过程的装置如图2所示,A装置须控制反应液的温度不高于60℃的原因是温度过高会导致HNO3分解,降低NaNO2的产率;B装置用于制备亚硝酸钠,其中盛放的溶液是b(填字母).
a.NaCl溶液b.Na2CO3溶液c.NaNO3溶液
(3)工业上在吸收过程中需控制NO和NO2的物质的量比接近1:1.若(NO):n(NO2)>1:1,则会导致排放气体中NO含量升高;若n(NO):n(NO2)<1:1会使产品中混有的杂质为NaNO3.
(4)已知NaNO2能把酸性条件下的Fe2+氧化,同时产生一种有毒的气体,请写出该反应的离子方程式:
NO2-+2H++Fe2+=NO↑+Fe3++H2O.
(5)已知:①NaNO2有氧化性,在酸性条件下能把I-氧化为I2;S2O32-又能把I2还原为I-.②NaNO2也有还原性,能使酸性KMnO4溶液褪色.为测定产品NaNO2的纯度,请补充完整实验方案:准确称量适量的NaNO2样品放入锥形瓶中,加适量水溶解,然后用c3mol•L-1酸性KMnO4溶液滴定至溶液由无色恰好变为浅红色,且半分钟内不褪色,读数,重复以上操作2~3次.
实验中可供选择的试剂:稀硫酸、c1 mol•L-1 KI溶液、淀粉溶液、c2 mol•L-1 Na2S2O3溶液、c3 mol•L-1酸性KMnO4溶液.
分析 木屑的主要成分是纤维素[(C6H10O5)n],酸溶后得葡萄糖溶液,用葡萄糖还原硝酸得NO和NO2,用NaOH吸收NO和NO2,得到NaNO2;HNO3不稳定,温度过高发生分解,所以反应温度不宜高于60℃,NaOH溶液呈碱性,可以用碳酸钠溶液代替,
(1)酸溶过程中,硫酸的作用是催化剂;
(2)硝酸易分解,则A装置须控制反应液的温度不高于60℃的原因是温度过高会导致硝酸的分解;反应中产生的NO2、NO被碳酸钠溶液吸收即转化为亚硝酸钠;
(3)NO和NO2的物质的量比=1:1时恰好可以看作亚硝酸,因此若(NO):n(NO2)>1:1,则会导致排放气体中NO含量升高;若n(NO):n(NO2)<1:1时NO2过量,则又会产生硝酸钠;
(4)已知NaNO2能把酸性条件下的Fe2+氧化,说明氮元素的化合价降低,同时产生一种有毒的气体,因此该气体是NO;
(5)由于NaNO2有还原性,能使酸性KMnO4溶液褪色,所以可以通过氧化还原滴定测定其纯度.
解答 解:(1)酸溶过程中,硫酸的作用是催化剂,
故答案为:催化剂或使纤维素水解成为葡萄糖;
(2)硝酸易分解,则A装置须控制反应液的温度不高于60℃的原因是温度过高会导致硝酸的分解,使NaNO2产率降低;反应中产生的NO2、NO被碳酸钠溶液吸收即转化为亚硝酸钠,
故答案为:温度过高会导致硝酸的分解,使NaNO2产率降低;b;
(3)NO和NO2的物质的量比=1:1时恰好可以看作亚硝酸,因此若(NO):n(NO2)>1:1,则会导致排放气体中NO含量升高;若n(NO):n(NO2)<1:1时NO2过量,则又会产生硝酸钠,即会使产品中混有的杂质为NaNO3,
故答案为:排放气体中NO含量升高;NaNO3;
(4)已知NaNO2能把酸性条件下的Fe2+氧化,说明氮元素的化合价降低,同时产生一种有毒的气体,因此该气体是NO,所以该反应的离子方程式为NO2-+2H++Fe2+=NO↑+Fe3++H2O,故答案为:NO2-+2H++Fe2+=NO↑+Fe3++H2O;
(5)由于NaNO2有还原性,能使酸性KMnO4溶液褪色,所以可以通过氧化还原滴定测定其纯度,因此实验方案设计为:准确称量适量的NaNO2样品放入锥形瓶中,加适量水溶解,然后用c3mol•L-1酸性KMnO4溶液滴定至溶液由无色恰好变为浅红色,且半分钟内不褪色,读数,重复以上操作2~3次,
故答案为:然后用c3mol•L-1酸性KMnO4溶液滴定至溶液由无色恰好变为浅红色,且半分钟内不褪色,读数,重复以上操作2~3次.
点评 本题考查物质制备实验方案设计与探究,为高频考点,把握制备原理、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度中等.

①C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H2=-285.8kJ/mol
③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
| A. | △H=+244.1kJ/mol | B. | △H=-488.3kJ/mol | C. | △H=-996.6kJ/mol | D. | △H=+996.6kJ/mol |
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | +1940 kJ•mol-1 | B. | -1940 kJ•mol-1 | C. | -485 kJ•mol-1 | D. | +485 kJ•mol-1 |
| A. | 实验中,乙烯的用量不会影响该反应的反应焓变△H | |
| B. | 0.5 mol H2O(l) 完全反应放出的热量为22.9 kJ | |
| C. | 1 mol C2H5OH(g)具有的能量大于1 mol C2H4(g)和1 mol H2O (g)所具有的能量和 | |
| D. | 1 mol C2H4(g)和1 mol H2O (g)中化学键的总键能大于1 mol C2H5OH(g)中化学键的总键能 |
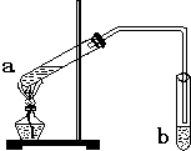 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制备,其中a中加乙醇、乙酸和浓硫酸,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制备,其中a中加乙醇、乙酸和浓硫酸,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.回答下列问题: