题目内容
3.在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)?C(g)+D(g)已达到平衡状态( )①混合气体的压强 ②混合气体的密度
③B的物质的量浓度 ④混合气体总物质的量
⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体总质量.
| A. | ①②③④⑤⑥⑦ | B. | ①⑤ | C. | ②⑤⑦ | D. | ①③④⑤ |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,据此分析解答.
解答 解:①反应前后气体的物质的量减少,压强减小,当混合气体的压强不变时,各物质的物质的量不变,该反应达到平衡状态,故正确;
②反应前后气体总质量不变,容器体积不变,所以密度始终不变,不能根据密度判断平衡状态,故错误;
③反应前后B的物质的量减少,B的物质的量减小,当B的物质的量浓度不变时,正逆反应速率相等,反应达到平衡状态,故正确;
④反应前后气体的物质的量减少,当混合气体总物质的量不变时正逆反应速率相等,反应达到平衡状态,故正确;
⑤反应前后气体的物质的量减少,则气体的平均相对分子质量增加,当混合气体的平均相对分子质量不变时,正逆反应速率相等,反应达到平衡状态,故正确;
⑥v(C)与v(D)的比值不变时,该反应可能达到平衡状态也可能没有达到平衡状态,与是否是正逆反应有关,故错误;
⑦反应前后混合气体总质量始终不变,所以不能据此判断平衡状态,故错误;
故选D.
点评 本题考查化学平衡状态判断方法,为高频考点,只有反应前后改变的物理量才能作为平衡状态判断依据,注意正确选取合适的物理量判断化学平衡状态,题目难度不大.

练习册系列答案
相关题目
13.根据下列热化学方程式:
①C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H2=-285.8kJ/mol
③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
①C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H2=-285.8kJ/mol
③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
| A. | △H=+244.1kJ/mol | B. | △H=-488.3kJ/mol | C. | △H=-996.6kJ/mol | D. | △H=+996.6kJ/mol |
11.有关能量的判断或表示方法正确的是( )
| A. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 | |
| B. | 从C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,可知:金刚石比石墨更稳定 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 | |
| D. | 化学反应中的能量变化,通常表现为热量的变化 |
18.已知S、SO2、SO3三种物质的质量比为2:4:5,它们的物质的量之比为( )
| A. | 10:5:4 | B. | 5:4:2 | C. | 2:4:5 | D. | 1:1:1 |
12.四种因素:①温度和压强 ②所含微粒数 ③微粒本身大小 ④微粒间的距离,其中对气态物质体积有显著影响的是( )
| A. | ②③④ | B. | ②④ | C. | ①③④ | D. | ①②④ |
 ,其中氧化剂是MnO2,还原剂是HCl.
,其中氧化剂是MnO2,还原剂是HCl.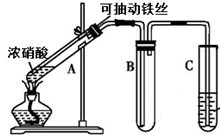 某校化学兴趣小组利用如图所示装置进行探究铁与浓硝酸的反应.
某校化学兴趣小组利用如图所示装置进行探究铁与浓硝酸的反应.