题目内容
5.下列说法正确的是( )| A. | 物质发生化学变化不一定伴随着能量变化 | |
| B. | 硫酸钡、醋酸铵、氨水都是弱电解质 | |
| C. | 向0.1 mol•L-1 Na2CO3溶液中滴加酚酞,溶液变红色 | |
| D. | 在温度、压强一定的条件下,自发反应总是向△H-T△S<0的方向进行 |
分析 A.化学变化中一定伴随物质变化、能量变化;
B.硫酸钡、醋酸铵熔融状态可完全电离,而氨水为混合物,电解质与非电解质必须为化合物;
C.Na2CO3溶液水解显碱性;
D.△H-T△S<0,反应可自发进行.
解答 解:A.化学变化中一定伴随物质变化、能量变化,通常表现为热量的变化,则依据热量变化,反应分为吸热反应、放热反应,故A错误;
B.硫酸钡、醋酸铵熔融状态可完全电离,二者均为强电解质,而氨水为混合物,电解质与非电解质必须为化合物,则氨水既不是电解质也不是非电解质,故B错误;
C.Na2CO3溶液水解显碱性,则向0.1 mol•L-1 Na2CO3溶液中滴加酚酞,溶液变红色,故C正确;
D.△H-T△S<0,反应可自发进行,则在温度、压强一定的条件下,自发反应总是向△H-T△S<0的方向进行,故D正确;
故选CD.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、水解反应、电解质判断为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
13.根据下列热化学方程式:
①C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H2=-285.8kJ/mol
③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
①C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H2=-285.8kJ/mol
③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
| A. | △H=+244.1kJ/mol | B. | △H=-488.3kJ/mol | C. | △H=-996.6kJ/mol | D. | △H=+996.6kJ/mol |
10.通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热(△H).下表是一些化学键的键能.
根据键能数据估算下列反应CH4(g)+4F2(g)═CF4(g)+4HF(g)的反应热△H为( )
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | +1940 kJ•mol-1 | B. | -1940 kJ•mol-1 | C. | -485 kJ•mol-1 | D. | +485 kJ•mol-1 |
17.对于一个放热反应,已知产物的总能量为90KJ,那么反应物的总能量可能是( )
| A. | 20KJ | B. | 40KJ | C. | 90KJ | D. | 100KJ |

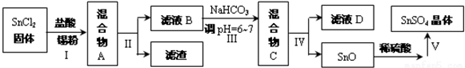
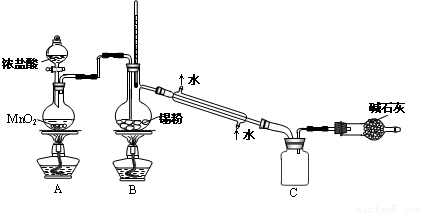
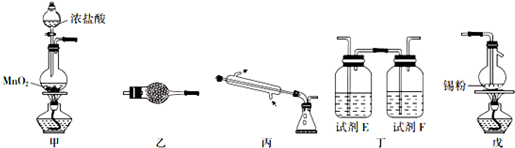
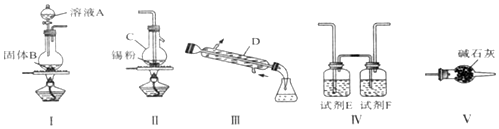
 ,其中氧化剂是MnO2,还原剂是HCl.
,其中氧化剂是MnO2,还原剂是HCl.