题目内容
2.氯化铁是常见的水处理剂,无水FeCl3易升华.工业上制备无水FeCl3的一种工艺如图1所示: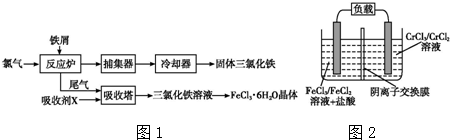
(1)加入吸收塔的吸收剂X应是c(填字母编号).
a.NaOH溶液 b.饱和食盐水c.FeCl2溶液 d.淀粉KI溶液
(2)取0.5mL饱和FeCl3溶液滴入50mL沸水中,得红褐色氢氧化铁胶体,则发生反应的离子方程式为 Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+.
(3)实验室中从FeCl3溶液制得FeCl3•6H2O晶体的过程中,需先加入盐酸且保持过量,然后进行的操作依次为蒸发浓缩、冷却结晶、过滤.
(4)将H2S气体通入FeCl3溶液中会出现浑浊,则其反应的离子方程式为H2S+2Fe3+═2Fe2++S↓+2H+.
(5)铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图2所示(电极材料为石墨),工作原理为:Fe3++Cr2+$?_{充电}^{放电}$Fe2++Cr3+
则电池放电时,Cl-将移向负极(填“正”或“负”);充电时,阴极的电极反应式为Cr3++e-═Cr2+.
分析 (1)通过工业上制备无水FeCl3的工艺流程图可知,从反应炉中排出的尾气是反应剩余的Cl2,与吸收剂X在吸收塔中反应生成FeCl3溶液,则吸收剂X应是FeCl2溶液;
(2)FeCl3溶液滴入50ml沸水中,FeCl3发生水解,再煮沸片刻得红褐色透明液体,形成氢氧化铁胶体;胶体粒子的直径为1~100nm;
(3)根据Fe3+的水解,需先加入盐酸且保持过量,然后依次进行蒸发浓缩、冷却结晶、过滤等操作;
(4)H2S气体通入FeCl3溶液中,Fe3+将H2S氧化为S,Fe3+被还原为Fe2+;
(5)电池工作时,电解质溶液中的阴离子移向负极;充电时,阴极阳离子得到电子发生还原反应;
解答 解:(1)通过工业上制备无水FeCl3的工艺流程图可知,从反应炉中排出的尾气是反应剩余的Cl2,与吸收剂X在吸收塔中反应生成FeCl3溶液,则吸收剂X应是FeCl2溶液,
故选:c;
(2)FeCl3溶液滴入50ml沸水中,FeCl3发生水解,再煮沸片刻得红褐色透明液体,形成氢氧化铁胶体,该过程可用离子方程式为:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+;
故答案为:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+;
(3)从FeCl3溶液制得FeCl3•6H2O晶体的过程中,为抑制Fe3+ 的水解,需先加入盐酸且保持过量,然后依次进行蒸发浓缩、冷却结晶、过滤等操作;
故答案为:盐酸;蒸发浓缩;
(4)H2S气体通入FeCl3溶液中,Fe3+将H2S氧化为S,Fe3+被还原为Fe2+,离子方程式为:H2S+2Fe3+═2Fe2++S↓+2H+;
故答案为:H2S+2Fe3+═2Fe2++S↓+2H+;
(5)电池工作时,电解质溶液中的阴离子移向负极,则铁铬氧化还原液流电池放电时,Cl-将移向负极;充电时,阴极阳离子得到电子发生还原反应,Cr3+得电子生成Cr2+,电极反应为:Cr3++e-═Cr2+;
故答案为:负;Cr3++e-═Cr2+.
点评 本题以工业上制备无水FeCl3流程为切入点考查胶体、盐的水解、实验基本操作、Fe3+的氧化性、电化学的相关知识,同时考查学生的分析问题和解决问题能力.

 53随堂测系列答案
53随堂测系列答案①C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H2=-285.8kJ/mol
③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为( )
| A. | △H=+244.1kJ/mol | B. | △H=-488.3kJ/mol | C. | △H=-996.6kJ/mol | D. | △H=+996.6kJ/mol |
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | +1940 kJ•mol-1 | B. | -1940 kJ•mol-1 | C. | -485 kJ•mol-1 | D. | +485 kJ•mol-1 |
| A. | 20KJ | B. | 40KJ | C. | 90KJ | D. | 100KJ |
| A. | 实验中,乙烯的用量不会影响该反应的反应焓变△H | |
| B. | 0.5 mol H2O(l) 完全反应放出的热量为22.9 kJ | |
| C. | 1 mol C2H5OH(g)具有的能量大于1 mol C2H4(g)和1 mol H2O (g)所具有的能量和 | |
| D. | 1 mol C2H4(g)和1 mol H2O (g)中化学键的总键能大于1 mol C2H5OH(g)中化学键的总键能 |
| A. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 | |
| B. | 从C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,可知:金刚石比石墨更稳定 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 | |
| D. | 化学反应中的能量变化,通常表现为热量的变化 |
| A. | ②③④ | B. | ②④ | C. | ①③④ | D. | ①②④ |
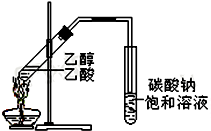 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题: